그만큼 각도 기하학 여러 유형 중 하나입니다. 분자 기하학, 여전히 선형, 피라미드, 평평한 삼각형, 사면체등 각도 기하학은 다음과 같은 특성을 가진 분자에서만 찾을 수 있습니다.
Triatomics, 즉 그들은 3 개의 원자 만 가지고 있습니다.
중심 원자에 적어도 세 개의 전자 구름이 있습니다.
노트 : 전자 클라우드는 모두 공유 결합 (단일, 이중, 삼중 또는 좌표) 원자와 전자 쌍 사이 원자가 층 통화에 참여하지 않는 사람.
각도 기하학을 가진 분자의 몇 가지 예를 참조하십시오.
첫 번째 예 : 물 (H2영형)

기존의 물 구조
물의 구조에는 다음이 있습니다.
3 개의 원자: 2 개의 수소와 1 개의 산소;
산소는 더 많은 수의 결합을 만들기 때문에 중심 원자입니다 (VIA 계열에 속하므로 2 개).
산소와 수소 사이의 두 개의 단일 결합. 이것은 각각의 수소가 하나의 결합과 산소를 두 개의 결합으로 만들 수 있기 때문입니다.
원자가 쉘에 6 개의 전자가 있고 결합에 2 개만 사용하므로 산소에 4 개의 비 결합 전자가 있습니다.
따라서 물 분자에서와 같이 중심 원자에는 3 개의 원자와 4 개의 전자 구름 (2 개의 단일 결합과 2 개의 비 결합 전자 쌍)이 있습니다. 기하학은 각도.
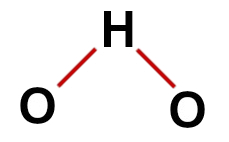
물의 올바른 구조식
노트 : 분자가 이러한 패턴을 나타낼 때마다 원자 사이에 형성되는 각도는 약 109º 28입니다.'.
두 번째 예 : 이산화황 (SO2)

이산화황의 기존 구조
이산화황의 구조에는 다음이 있습니다.
3 개의 원자: 2 개의 산소와 1 개의 황 원자;
모든 원소가 같은 수의 결합 (2 개)을 만들어야하기 때문에 황은 분자에서 가장 작은 원소이기 때문에 중심 원자입니다.
황과 산소 중 하나 사이의 이중 결합. 둘 다 두 개의 연결이 필요하기 때문입니다.
하나 좌표 또는 dative 공유 결합왜냐하면 유황은 다른 산소와 짝을 이룬 후에 안정되었지만 여전히 두 개의 전자를 필요로하는 산소 원자가 있기 때문입니다.
산소에있는 4 개의 비 결합 전자. 이는 산소가 원자가 껍질에 6 개의 전자를 갖고 결합에 2 개만 사용하기 때문입니다.
따라서 이산화황 분자에서와 같이 중심 원자에는 3 개의 원자와 4 개의 전자 구름 (2 개의 단일 결합과 2 개의 비 결합 전자 쌍)이 있습니다. 기하학은 각도.
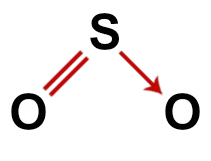
이산화황의 올바른 구조식
노트 : 분자가 이러한 패턴을 가질 때마다 원자 사이에 형성되는 각도는 약 120입니다.영형.
나. Diogo Lopes Dias
출처: 브라질 학교- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm


