수천 개의 유기 화합물이 있기 때문에 이성질체 현상은 여러 형태를 취할 수 있습니다. 따라서 이성질체는 기본적으로 두 가지 유형으로 분류 될 수 있습니다. 편평한 또는 헌법 적 이성질체 과 공간 이성질체 또는 입체 이성질체. 언급 된 각 유형은 다음 다이어그램과 같이 세분화 될 수 있습니다.
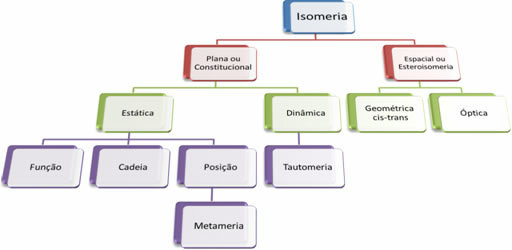
각 사례보기 :
1. 플랫 또는 헌법 이성질체 : 이 유형의 이성질체는 동일한 분자식을 가지며 평평한 구조식으로 구별됩니다. 평면 이성화에는 기능, 사슬, 위치, 대사, 호변 이성화의 다섯 가지 경우가 있습니다.
1.1.기능적 또는 기능적 이성질체: 이성체의 차이점은 작용기에 있습니다.
예: 분자식 C3H6영형
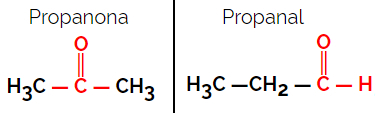
프로판 온은 케톤 그룹에서, 프로판 알은 알데히드 그룹에서 나옵니다.
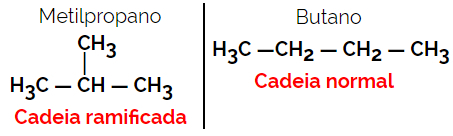
1.2. 사슬 또는 골격 이성질체 : 이성질체의 차이점은 사슬의 유형에 있습니다. 예를 들어, 하나의 이성질체는 개방 사슬이고 다른 하나는 폐쇄 사슬이거나, 하나는 정상 사슬이고 다른 하나는 분지 사슬이거나, 하나는 동종 사슬이고 다른 하나는 이종 사슬이다.
예: 분자식 C4H10
1.3.위치 또는 위치 이성질체 : 차이는 불포화, 작용기, 헤테로 원자 또는 치환기의 위치에 있습니다.
예: 분자식 C4H6

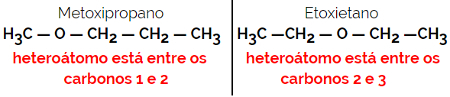
1.4.보상 이성질체 또는 메타 메리: 이것은 특별한 유형의 위치 이성질체로, 차이는 헤테로 원자의 위치입니다.
예: 분자식 C4H10영형
1.5.동적 Isomery 또는 Tautomery : 이것은 이성질체가 용액에서 동적 평형 상태에서 공존하는 특수한 유형의 기능 이성질체입니다. 두 가지 주요 유형의 타우 토 메리아는 케톤과 에놀 (케토에 놀 균형) 사이와 알데히드와 에놀 (알도에 놀 균형) 사이입니다.
예: 분자식 C3H6영형
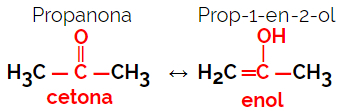
2. 공간 이성질체 또는 입체 이성질체 : 이 경우 이성질체 간의 차이는 공간에서 원자의 방향을 통해서만 시각화 할 수 있습니다. 입체 이성질체에는 기하학적 이성질체와 광학 이성질체의 두 가지 유형이 있습니다.
2.1.기하 또는 시스-트랜스 이성질체: 차이점은 cis 이중 결합 또는 평면의 같은면에있는 고리 형 화합물에서 동일한 탄소 리간드를 가지고 있습니다. 이성질체 리간드 트랜스 반대편에 있습니다.
예: 분자식 C2H2Cl2

이 화합물은 입체 이성질체.
2.2.광학 이성질체: 이성질체가 편광 광선을 굴절시킬 수있을 때 발생합니다. 편광 된 광선을 왼쪽으로 구부리면 좌회전 이성체이지만 오른쪽으로 구부리면 오른손 이성체라고합니다.
예:
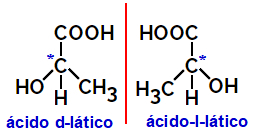
위에 표시된 것과 같이 서로 거울상이며 겹쳐지지 않는 비대칭 분자를 거울상 이성질체.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm
