20ºC에서 물 100g이 담긴 유리 잔에 10g의 식염 (염화나트륨-NaCl)을 첨가한다고 상상해보십시오. 혼합 후 소금이 완전히 녹아서 소금을 더 추가하기로 결정합니다. 어느 시점에서, 당신은 더 이상 그 양의 물에 소금을 녹일 수 없을 것이며, 첨가 된 소금은 아무리 세게 섞어도 유리 바닥에 가라 앉을 것입니다.
그럴 때 해결책은 가득한 그리고 그 용해도 계수. 따라서 다음과 같이 용해도 계수를 정의 할 수 있습니다.
“용해도 계수는 주어진 온도에서 주어진 양의 용매에 용해되는 용질의 최대량입니다.”
예를 들어 물에서 소금의 용해도 계수는 다음과 같습니다. 20ºC에서 36g의 NaCl / 100g의 물. 이 양의 물과이 온도에서 여분의 소금 1g을 녹일 수 없습니다. 용해도 계수는 각 물질에 따라 다릅니다. 예를 들어 식염을 NH로 바꾸는 등 용질을 바꾸면4Cl, 이것은 용해도 계수가 20 ° C에서 물 100g에 37.2g.
더욱이, 동일한 물질이 다른 용매에서 다른 용해도를 가짐. 소금은 물에 용해되지만 아세톤이나 에틸 아세테이트 (유약을 제거하는 데 사용되는 용매)에는 거의 용해되지 않습니다.
또 다른 점은 주어진 양의 용매에서 용질의 용해도 계수가 언급 될 때마다 온도를 표시하는 것도 필요합니다, 이것이 방해 요인이기 때문입니다. 예를 들어, 20 ° C에서 물 100g을 취하고 소금 40g을 추가하면 36g이 용해되고 4g이 침전물을 형성합니다. 그러나이 용액을 가열하면 온도가 상승함에 따라 4g이 용해되는 것을 볼 수 있습니다.
이것은 동일한 양의 용매에 용해 된 동일한 용질이 온도가 증가함에 따라 다른 용해도 계수를 갖는다는 것을 보여줍니다.
아래 예를 참조하십시오.
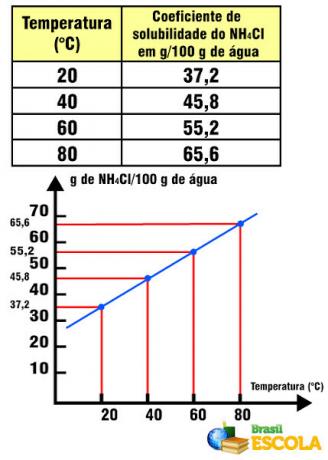
NH 용해도 계수4온도와 관련된 Cl
이 경우 NH의 용해도 계수는4Cl은 온도가 증가함에 따라 증가합니다. 이것은 물에있는 대부분의 소금에서 발생합니다. 그러나 Ce의 경우와 같이 온도가 증가함에 따라 용해도 계수가 감소하는 상황이 있습니다.2(뿐4)3. 또한 식염에서 발생하는 것처럼 용해도 계수에 현저한 변동성이없는 경우도 있습니다. 본문에서 이것을보십시오 용해도 곡선 그래프.
특정 상황에서 용해도 계수보다 더 큰 용매에 용질을 용해시켜 소위 과포화 용액. 예를 들어, 20 ° C에서 100g의 물과 40g의 식염 (36g 용해되고 4g이 침전 됨), 모든 용질이 온도에 도달 할 때까지 가열 자신을 용해 시키십시오. 그런 다음이 용액을 그대로 두어 20ºC에 가까운 실온에 도달 할 때까지 식 힙니다.
용액에 방해가 없으면 여분의 용질이 용해 된 채로 남아있어 과포화 용액을 구성합니다. 그러나 이러한 유형의 용액은 매우 불안정하며 갑작스러운 움직임으로 인해 해당 온도에 대한 용해도 계수 이상의 양이 결정화 될 수 있습니다. 따라서 솔루션은 과포화 될 것입니다 배경 본문으로 포화.
마지막 경우는 불포화 용액, 용해 된 용질의 양이 용해도 계수의 값보다 적을 때입니다. 한 가지 예는 20 ° C에서 물 100g에 NaCl 10g을 용해하는 것입니다.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm

