가정에서 음식을 조리 할 때 가스 연소를 사용합니다. 이 가스의 연소로 인한 불꽃에서 우리가 볼 수있는 것 중 하나는 그 색깔이 일반적으로 매우 밝은 파란색이라는 것입니다. 그러나 양초를 태우는 것과 같은 대부분의 연소 반응에서 불꽃은 노란색입니다.

그런 다음 질문이 발생합니다.
"모든 화재가 연소 반응의 결과라면 왜 일부 화염의 색이 다른가요?"
이것이 어떻게 일어나는지 이해하려면 연소 반응이 무엇인지, 그리고 언급 된 각 반응에 어떤 물질이 존재하는지 이해해야합니다.
연소 반응은 연료 (산화성 물질)가 산화제 (산소를 포함하는 기체 물질)에 의해 소비되어 열 에너지 (열)를 생성 할 때 발생합니다.
연소 반응에 대해 알아야 할 또 다른 중요한 점은 연소 반응이 완전 또는 불완전. 연료를 소비하기에 충분한 산소가 있으면 반응이 완료되고 이산화탄소 (CO2) 및 물(H2영형). 그렇지 않으면 연소가 부분적이고 불완전하여 일산화탄소 (CO)와 물을 생성합니다. 또는 탄소 (C)와 물.
우리가 분석하는 두 경우 모두 산화제는 공기 중에 존재하는 산소입니다. 그러나 연료는 다릅니다. 요리 용 가스는 실제로 액화 석유 가스 (LPG)로 탄화수소 (알칸)의 혼합물이며 주 연료는 부탄 (C4H10). 따라서 요리 가스는 알칸 분자로 구성됩니다. 3 개 또는 4 개의 탄소 원자, 그래서 완전히 연소되는 데 산소가 거의 필요하지 않습니다.. 이 반응은 다음과 같이 표현할 수 있습니다.
1C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 시간2영형(지), ∆H <0
양초의 경우 파라핀은 반응의 연료이며 알칸과 탄소 원자의 혼합물로 구성되어 있습니다. 20에서 36까지의 범위. 그것에 의하여, 이 반응이 완전히 일어나려면 더 많은 산소가 필요합니다.. 예를 참조하십시오.
1C24H50 (초) + 70/2 O2 (g) → 25 CO2 (g) + 25 시간2영형(지), ∆H <0
공기 중에는이 완전 연소를 수행하기에 충분한 산소가 없기 때문에 아래와 같이 불완전하게 발생합니다.
1C24H50 (초) +49/2 O2 (g) → 24 CO(지) + 25 시간2영형(지), ∆H <0
1C24H50 (초) +25/2 O2 (g) → 24C(에스) + 25 시간2영형(지), ∆H <0
불완전한 반응은 완전 연소보다 적은 에너지를 생성합니다. 불완전 연소의 특징 인 노란색 불꽃은 에너지가 낮기 때문에 불꽃의 색 차이를 설명합니다. 푸른 불꽃은 더 큰 에너지로 완전 연소의 특징입니다.
이것은 또한 불완전 연소의 산물로 간주되는 탄소 인 양초 불꽃 (아래 사진)에 의한 그을음의 형성을 설명합니다.
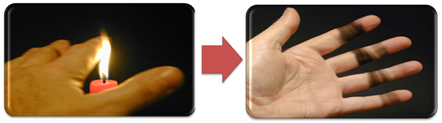
그러나 분젠 버너에서 연료가 변하지 않는데 왜 노란색과 파란색 불꽃이 생길 수 있습니까?
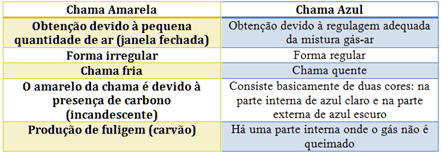
분젠 버너의 경우 가스와 공기의 유입을 조절함으로써 가능합니다. 창이 닫혀서 소량의 공기가 유입되면 화염이 노란색이됩니다. 왜냐하면 완전 연소를 수행하기 위해 산소가 거의 없기 때문입니다. 가스-공기 혼합물의 규제가 적절하면 푸른 불꽃이 생깁니다.
아래 표에서 각각의 특성을 참조하십시오.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm

