과학자 프리드리히 콜라 우쉬 (1840-1910)는 비록 소규모이지만 순수한 물이 전기를 전도한다고 제안한 최초의 사람입니다. 이것은 물이 양쪽 성 방식으로 작용하기 때문입니다. 즉, 특정 경우에는 산처럼 작용하여 양성자 (H+); 다른 것에서는 양성자를받는 염기처럼 행동합니다.
이것은 물이 아래에 표시된 화학 방정식에 따라 자체적으로 이온화를 수행함을 의미합니다.
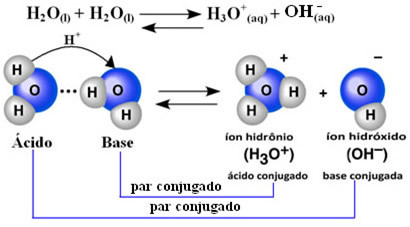
이 과정을 물 자동화 그리고 그것은 매우 작은 규모로 발생합니다. 즉, 물은 평형에서 낮은 이온화도 및 이온화 상수 (K씨). 이것이 바로 물의 전도도가 낮은 이유입니다.
아이디어를 얻으려면 25 ° C의 주변 온도에서 순수한 물의자가 이온화에서 생성되는 수산화물 및 하이드로 늄 이온의 농도가 1과 같다는 것을 결정할 수 있습니다. 10-7 몰. 엘-1. 이것은 10 억 개의 물 분자 중 2 개만 이온화된다는 것을 의미합니다.
물의 이온 균형 상수는 씨물 해리 상수,autoprotolysis 상수또는 물의 이온 생성물.이 상수는 다음과 같이 표현됩니다. 케이w, w는 단어를 참조하기 때문에 물, 영어로 물을 의미합니다.
그 계산은 다른 평형 상수와 같은 방식으로 수행됩니다. Balance Kc and Kp”,이 경우 액체 상태의 물은 동일한 활성을 갖기 때문에 제품 만 표현에 나타납니다. 1로. 순수한 액체 또는 고체 물질은 변하지 않기 때문에 해리 상수 표현에 넣지 않습니다. 수성 및 기체 용액 만 배치됩니다. 그래서 우리는 :
케이w = [H3영형+]. [오-]
케이w = (1. 10-7). (1. 10-7)
케이w = 10-14
다른 평형 상수와 마찬가지로 확인w 온도 변화에 따라 변합니다. 물의 온도가 상승함에 따라 이온화도 증가합니다. 즉, 물의자가 이온화는 흡열 과정, 즉 열을 흡수합니다.
이것은 물의 이온 생성물 값 (Kw) 다른 온도에서 아래 표에 나와 있습니다.
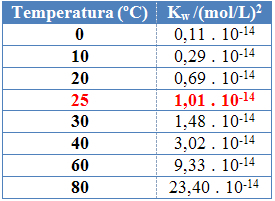
물의 이온 생성물은 순수한 물이든 용액이든 항상 각 온도에서 고정 된 값을 갖습니다. 용액에 H 이온 농도가 있어도3영형+ 그리고 오- 다르면 그들 사이의 제품은 일정하게 유지됩니다.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm