NS 엔탈피 는 열역학적 함수입니다. 등압 과정과 관련된 열을 계산합니다.즉, 일정한 압력을 받는 상태로 유지됩니다. 그것의 발전은 열량 이론의 몰락 직후에 일어났고, 열역학 1840년에서 1850년 사이.
엔탈피, 뭐라고 요우미카, 절대적이고 고립된 값으로 취급하면 큰 의미가 없지만, 화학 공정에서 그 가치의 변화. 프로세스의 엔탈피 변화를 계산하는 몇 가지 방법이 있으며, 주요 방법은 형성, 결합 및 거기헤이에서 헤이.
너무 읽기: 깁스 자유 에너지란 무엇입니까?
엔탈피 요약
엔탈피는 일정한 압력에서 발생하는 프로세스와 관련된 열을 계산하기 위한 열역학적 도구입니다.
미국 물리학자 Josiah W. 열량 이론의 몰락의 맥락에서 Gibbs.
화학에서 우리는 항상 ΔH로 표시되는 엔탈피 변화를 사용합니다.
열을 흡수하는 화학 반응을 흡열 반응이라고 하며 ΔH > 0입니다.
열을 방출하는 화학 반응을 발열 반응이라고 하며 ΔH < 0입니다.
엔탈피에 대한 비디오 수업
엔탈피란?
항상 H로 표시되는 엔탈피는 초기에 미국 물리학자 Josiah Willard Gibbs가 정의한, 그는 일정한 압력에서의 열 함수라고 불렀습니다.
"[...] 기능의 감소는 압력이 변하지 않는 모든 경우에 시스템이 포기한 열을 나타냅니다."
Gibbs의 연구에서 우리는 엔탈피를 열역학적 함수로 이해할 수 있습니다. 변동은 시스템에서 교환되는 열의 양과 수치적으로 같습니다. 압력 일정한. 이는 등압 공정(대부분의 화학 공정과 마찬가지로)에서 엔탈피 함수의 변화를 계산하면 시스템과 시스템 사이에서 교환되는 열의 값을 알 수 있습니다. 이웃.

이러한 열 원인과의 상관관계 많은 학생들이 엔탈피가 다음과 동의어라고 잘못 생각합니다. 열 또는 에너지 함량, 열 함량, 방출된 열 및 흡수된 열 등과 같은 것.
엔탈피는 열을 더 따뜻한 물체에서 더 차가운 물체로 전달되는 헤아릴 수 없는 물질적 물질로 취급한 열량 이론의 붕괴와 관련하여 발생했습니다. 따라서 열을 계산하기 위한 새로운 도구가 필요했습니다. 따라서 해결책은 엔탈피와 같은 열역학 방정식을 이미 정의한 양을 사용하는 것이었습니다.
너무 읽기: 용액의 엔탈피 변화를 계산하는 방법은 무엇입니까?
엔탈피 변동
엔탈피는 화학 공정에서 교환되는 열을 계산하는 데 사용되는 도구이므로 절대적이고 고립 된 숫자로 사용하는 것은 의미가 없지만 열역학은 열역학이 변형은 공정에서 방출되거나 흡수된 열과 수치적으로 동일.
엄밀히 말하면 엔탈피 변동을 다음과 같이 정의할 수 있습니다.
ΔH = H결정적인 - 시간초기의
화학 공정에서와 마찬가지로 최종 단계는 제품으로 간주될 수 있고 초기 단계는 시약으로 간주될 수 있습니다. 엔탈피 변동의 정의를 다음과 같이 보는 것도 일반적입니다.
ΔH = H제품 - 시간시약
실용적이고 해석적인 관점에서, 엔탈피 변화가 양수인 경우(△H> 0), 우리는 화학 반응이 흡열즉, 공정 전반에 걸쳐 열 흡수가 있습니다. 이미 엔탈피 변화가 음수이면(ΔH< 0), 우리는 화학 반응이 발열즉, 공정 전반에 걸쳐 열이 방출됩니다.
많은 경우에 엔탈피 변화는 다음 예와 같이 그래프에서 관찰됩니다.
예 1:
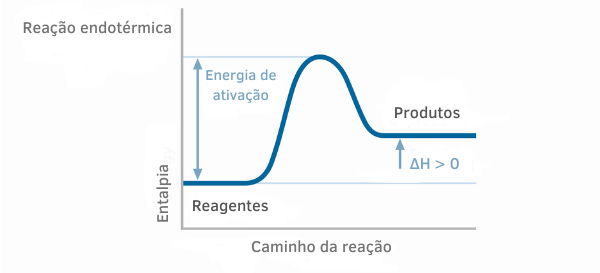
흡열 반응 차트
흡열 반응에 대한 엔탈피 그래프에서 생성물의 엔탈피 양이 반응물의 엔탈피보다 큰 것을 볼 수 있으며, 이는 반응에 따른 변화가 양수임을 나타냅니다. 따라서 ΔH> 0이면 열 흡수와 함께 화학 공정이 발생했다고 말할 수 있습니다.
예 2:
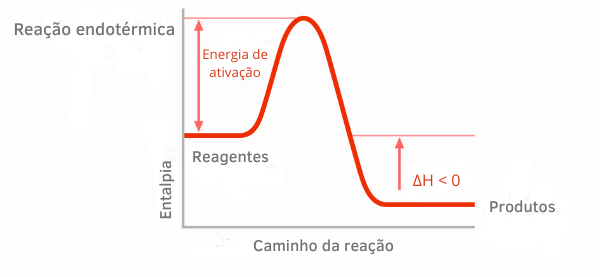
발열 반응 도표:
발열 반응에 대한 엔탈피 그래프에서 생성물의 엔탈피 양이 반응물의 엔탈피보다 작아서 반응에 따른 변화가 음수임을 나타냅니다. 따라서 ΔH < 0이면 열 방출과 함께 화학 공정이 발생했다고 말할 수 있습니다.
텍스트에서 이러한 화학 반응 분류에 대해 자세히 읽어보십시오. 을위한흡열 및 발열 과정.
엔탈피의 종류
형성 엔탈피
NS 형성 엔탈피 é 계획된 를 기반으로 형성 화학 반응, 상온과 1기압에서 가장 안정한 단순 물질로부터 1몰의 화합물이 형성되는 반응이다.
시간2(g) + ½ O2 (g) → H2O (l) H°NS = -286kJ/mol
생성 엔탈피의 가장 큰 장점은 실온과 1기압에서 더 안정적인 단순 물질의 엔탈피가 0에 동의한다는 것입니다. 이것은 그들이 실제로 0이라는 말은 아니지만 단순화와 더 나은 분류를 위해 다음과 같이 처리됩니다.
존재 시간 = H제품 - 시간시약, 우리가 고려한다면, 그 H시약 = 0, 우리는 ΔH의 관찰 값은 제품에만 관련이 있다고 말할 수 있습니다. 이러한 경우에는 항상 복합 물질의 1 몰입니다. 따라서 이 값을 ΔH°로 표시되는 물 형성의 표준 엔탈피 변동으로 표로 표시합니다.NS.
이 방법론을 통해 여러 물질의 변형이 있었습니다. 표준 엔탈피 아래에서 볼 수 있듯이 형성 테이블.
물질 |
형성 엔탈피(ΔH°NS) kJ/mol |
CO2 (NS) |
-393,4 |
CaO |
-634,9 |
HI(g) |
+25,9 |
아니오 (g) |
+90,1 |
결합 엔탈피
결합 엔탈피는 주어진 두더지의 파열 또는 형성과 관련된 에너지의 양을 나타내는 역할을 합니다. 화학 결합.
이해되며, 화학 결합을 끊으려면 열을 흡수해야합니다, 결합 원자가 증가하도록 내부 에너지 결과적으로 운동 에너지를 증가시킵니다. 더 큰 운동 에너지, 원자가 더 강하게 진동하여 결합이 끊어집니다. 따라서 모든 결합 끊기는 흡열 과정입니다.
그렇지 않으면 화학 결합을 형성하기 위해 원자가 운동의 자유를 잃고 운동 정도를 줄여 운동 에너지를 감소시켜야 합니다. 여분의 에너지는 열의 형태로 방출됩니다. 따라서, 모든 결합 형성은 발열 과정입니다.
아래 표는 각 화학 결합과 관련된 에너지 값을 보여줍니다.
연결 |
결합 에너지(kJ/mol) |
C-H |
412,9 |
CC |
347,8 |
오═O |
497,8 |
F-F |
154,6 |
아니요 |
943,8 |
값은 계수이므로 부호가 없습니다. 연결이 끊어졌는지 형성되었는지에 따라 신호를 할당받아야 하기 때문입니다.
연소 엔탈피
NS 연소 엔탈피 나타내는 역할을 한다 물질 1몰이 연소될 때 방출되는 열량. 모든 연소 반응은 열을 방출하므로 모든 연소 반응은 발열 반응이라는 점에 유의해야 합니다.
채널4 (g) + 2 O2 (g) → CO2 (g) + 2시간2ΔH°씨 = -889.5kJ/mol
아래 표는 일부 화학 물질의 연소 엔탈피 값을 보여줍니다.
물질 |
연소 엔탈피(ΔH°씨) kJ/mol |
에탄올 - C2시간5오 (1) |
-1368 |
벤젠 - C6시간6 (1) |
-3268 |
옥탄 - C8시간18 (1) |
-5471 |
포도당 - C6시간12영형6 (NS) |
-2808 |
물리적 상태 변화의 엔탈피
물리적 상태의 모든 변화에는 열 교환이 포함됩니다. 따라서 물리적 상태 변화의 엔탈피 나타내는 역할을 한다 물리적 상태 변화 과정과 관련된 열량.
예를 들어, 우리는 수증기가 있습니다:
시간2오 (1) → H2O (g) ΔH = +44 kJ/mol
물이 녹을 때 다음이 있습니다.
시간2O(들) → H2O(l) ΔH = +7.3 kJ/mol
엔탈피 값은 역 과정에 대해 대칭입니다., 이는 예를 들어 물의 액화 엔탈피 변화가 -44 kJ/mol인 반면, 응고에서는 -7.3 kJ/mol과 같다는 것을 의미합니다.
너무 읽기: 엔트로피란?
엔탈피에 대한 풀이 연습
질문 1 - (UERJ 2018) 연료로 사용되는 탄화수소의 오염 용량은 방출되는 에너지와 CO의 양 사이의 비율에 의해 결정됩니다.2 완전 연소로 형성됩니다. 비율이 높을수록 오염 능력이 낮아집니다. 아래 표는 4가지 탄화수소의 표준 연소 엔탈피를 보여줍니다.

표에서 오염 용량이 가장 낮은 탄화수소는 다음과 같습니다.
옥탄
헥산
벤젠
펜탄
해결
대안 D
이 질문은 오염 용량이 방출된 에너지와 CO의 양 사이의 비율(상수)로 정의됨을 나타냅니다.2 완전 연소로 형성됩니다. 더 큰 이유, 오염 용량이 낮을수록, 즉 CO 1몰당 더 많은 에너지가 방출됩니다.2 생성.
의 완전 연소 반응 탄화수소 인용된 것은:
옥탄: 씨8시간18 +25/2 O2 → 8 CO2 + 9시간2이유: 5440/8 = 680
헥산: 씨6시간14 +19/2 O2 → 6 CO2 + 7시간2이유: 4140/6 = 690
벤젠: 씨6시간6 + 15/2 O2 → 6 CO2 + 3시간2이유: 3270/6 = 545
펜탄: 씨5시간12 + 8 오2 → 5 CO2 + 6시간2이유: 3510/5 = 702
따라서 펜탄이 가장 낮은 오염 용량을 가진 탄화수소라는 결론을 내릴 수 있습니다.
질문 2 - (Enem 2015) 산림 잔류물의 사용은 재생 가능한 에너지원이기 때문에 매일 더 매력적으로 되고 있습니다. 그림은 목재 폐기물에서 추출한 바이오 오일의 연소를 나타냅니다. 여기서 ΔH1 이 바이오 오일 1g의 연소로 인한 엔탈피 변화로 인해 이산화탄소와 액체 물이 생성되고 ΔH2 기체 상태의 물 1g이 액체 상태로 전환될 때의 엔탈피 변화.

이 바이오 오일 5g을 태울 때의 엔탈피 변화(kJ)2 (기체) 및 H2(기체)는 다음과 같습니다.
가) -106
나) -94
다) -82
라) -21.2
마) -16.4
해결
대안 C
표시된 그래프에서 ΔH1 CO를 생성하는 바이오 오일 연소의 엔탈피 변화로2 (g) 및 H2O(1) 및 ΔH2 물 액화의 엔탈피 변화로서, CO2 기체 상태로 남아 있고 물리적 상태만 물 변화(기체에서 액체로).
이 운동은 5g의 바이오 오일을 태울 때의 엔탈피 변화를 요구하며, 그 결과 CO2 (기체) 및 H2O(기체). 다이어그램에서 이 엔탈피 변화는 ΔH = ΔH로 정의할 수 있습니다.1 - 시간2. 따라서 ΔH의 값은 -16.4 kJ/g와 같습니다. 단위에서 볼 수 있듯이 이 변형은 바이오 오일의 각 그램에 대한 것입니다. 5g의 경우, 우리는 다음을 수행해야 합니다. 비율:
바이오 오일 1g -16.4 kJ
바이오 오일 x 5g
1. x = 5. (-16,4)
x = -82kJ
그런 다음 대안 C를 표시할 수 있습니다.
스테파노 아라우조 노바이스
화학 선생님
