메커니즘은 반응이 처리되는 방식의 시뮬레이션이며 반응물이 최종 제품에 도달하기 위해 거쳐야 하는 단계를 설명합니다.
반응을 단계별로 시각화할 수 없고 매우 유용하기 때문에 실험을 기반으로 메커니즘을 제안했습니다. 유기 화합물은 다양한 방식으로 서로 반응하여 결합을 끊고 화합물을 형성하는 유기 화학 중개자.
예를 들어, 용매의 성질, 결합의 극성, 전자 교환 등과 같은 반응의 최종 생성물을 방해하는 요인이 있습니다. 따라서 특정 메커니즘이 항상 제품 형성을 위한 유일한 방법은 아니며 이온적으로 또는 자유 라디칼을 통해 다양한 방식으로 발생할 수 있습니다.
1. 이온 메커니즘: 공유 결합의 이종 분해 파열과 이온 형성(탄화 양이온 및 탄소 음이온)을 통해 시작되는 과정입니다.
알켄 할로겐화 메커니즘을 추적합니다.
메커니즘을 단계로 나눌 수 있습니다.
1단계: 공유 결합(Cl-Cl)의 이형 분해 파괴: 탄소 양이온과 음이온(Cl-)의 형성.
2단계: Chloride anion(Cl-)이 carbocation을 공격합니다.
3단계: 생성물의 형성 1,2 - 디클로로프로판.
알켄의 할로겐화는 이온 메커니즘을 통해 발생합니다.
참고: 이름에서 알 수 있듯이 할로겐화는 분자에 할로겐(염소)을 추가하여 수행됩니다.
2. 자유 라디칼을 통한 메커니즘: 공유 결합의 균일 파열은 자유 라디칼을 형성합니다(매우 불안정하고 반응성이 있음). 예를 살펴보겠습니다.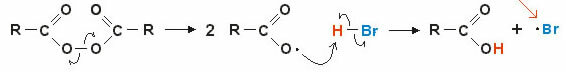
반응은 과산화 결합이 끊어지고 자유 라디칼이 형성되면서 시작됩니다. 중간 단계에서 (H — Br)의 극성화된 수소에 라디칼 공격이 발생하고 결과적으로 새로운 자유 라디칼이 형성됩니다. 브 (매우 불안정하고 반응성이 있음).
리리아 알베스
화학과 졸업
브라질 학교 팀
더보기!
유기 화학의 라디칼
유기화학 - 화학 - 브라질 학교
원천: 브라질 학교 - https://brasilescola.uol.com.br/quimica/mecanismos-reacoes-organicas.htm

