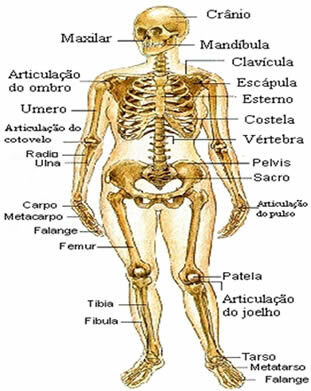
영형 Le Chatelier의 원리 평형 상태의 시스템에 교란이 발생하면 교란에 의해 생성되는 힘을 최소화하고 새로운 화학적 평형을 회복하는 방향으로 이동합니다.
이러한 장애 중 하나는 온도 변화. 이 변동은 평형 이동을 유발하는 것 외에도 평형 상수 K의 값을 변경하기 때문에 중요합니다.씨.
이것이 어떻게 발생하는지 더 잘 이해하기 위해 예를 살펴 보겠습니다.
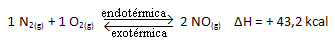
케이씨 = _[ 에서]2___
[엔2]. [영형2]
위의 반응은 에너지 흡수와 함께 직접적인 방향으로 발생하며 흡열입니다. 반면에 역 과정은 발열 반응 인 에너지 방출과 함께 발생합니다.
따라서 시스템의 온도를 높이면 화학적 평형이 흡열 반응으로 이동하며, 이 반응에서는 오른쪽에 있습니다. 이것은 열이 흡수되고 평형을 회복하기 위함입니다.
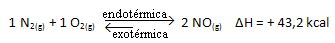
그 반대도 사실입니다. 이 시스템의 온도를 낮추면 반응의 총 에너지가 감소하기 때문에 열을 방출하는 방향으로 반응이 이동합니다. 이것은 균형이 발열 반응으로 이동한다는 것을 의미하며, 이 경우에는 왼쪽에 있습니다.
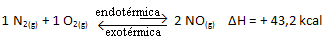
요컨대 :

평형 상수 (K씨), 온도가 상승하면 흡열 반응에 유리하고 NO(지) 농도가 증가하고 반응물의 농도가 감소합니다. 아래 공식에서 NO 농도는(지) 상수 K에 정비례합니다.씨따라서 다음과 같이 증가합니다.
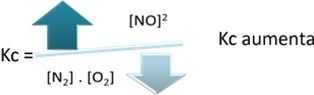
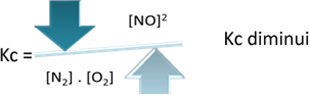
그러나 온도를 낮추고 반응을 발열 반응으로 전환하면 NO 생성물의 농도가 감소하고 반응물의 농도가 증가합니다. 반응물의 농도는 상수 Kc에 반비례하므로 감소합니다.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm