sp 형 탄소의 혼성화2 이중 결합과 두 개의 단일 결합 또는 파이 결합 (π)과 세 개의 시그마 결합 (σ)이있을 때 발생합니다. 사실, sp 혼성화2 이중 결합을 형성하는 원자 사이에서 발생합니다.
이러한 분자의 예는 포름 알데히드 (CH2영형). 아래 구조를 참고하십시오.
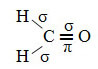
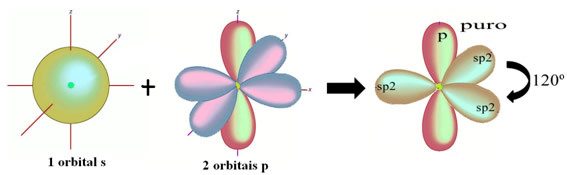
텍스트에서 볼 수 있듯이 "sp 유형 혼성화3”, 탄소 혼성화는 하위 수준 2s의 전자가 에너지를 받고 2p 하위 수준, 따라서 원자 궤도의 "혼합"에서 4 개의 혼성화 궤도를 생성합니다. 순수한.
포름 알데히드의 경우 파이 결합이 있다는 것을 알고 있으므로 이러한 혼성 궤도 중 하나는이 결합을 위해 예약되고 나머지 세 개는 시그마 결합을 가지고 있습니다.
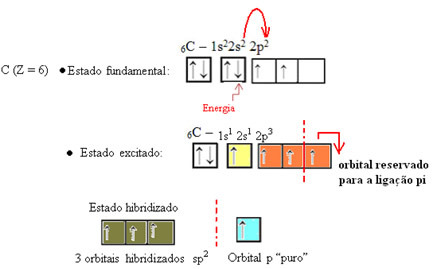
탄소와 단일 결합을 만드는 수소 원자는 s 궤도로 만듭니다.
나머지 "순수한"p 궤도는 산소 원자를 이중 결합하고 포름 알데히드 분자는 다음과 같은 구조를 가지고 있습니다.
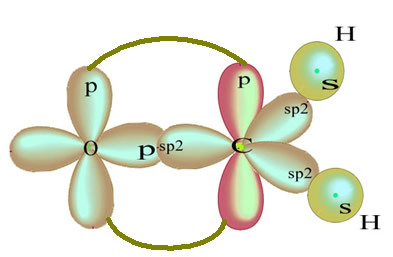
이 포름 알데히드 구조에 존재하는 결합 유형은 다음과 같습니다.

사이: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm

