두 용액이 섞여있을 때, 서로 다르 든 아니든 먼저 두 용액 사이에 반응이 있는지 분석해야합니다. 예를 들어 물과 설탕 (자당 수용액)의 용액을 소금 (염수)과 물의 용액과 혼합하면 화학 반응없이 용액 혼합.
농도가 다른 두 가지 염화나트륨 (NaCl) 용액을 혼합해도 마찬가지입니다. 이 경우에도 반응이 없습니다. 그런 다음이 예제를 화학 반응없이 동일한 용질의 용액 혼합, 첫 번째 예는 화학 반응없이 서로 다른 용질의 용액 혼합.
두 경우 모두 용액 성분의 화학적 구성은 변경되지 않습니다.그러나 일부 정량적 측면은 다시 계산해야합니다.
반응이없는 용액 혼합물의 몰 농도 (Molarity)와 일반적인 농도를 결정하는 방법을 이해하기 위해 언급 된 두 가지 경우의 분해능을 살펴 보겠습니다.
1st) 화학 반응이 발생하지 않는 동일한 용질의 용액 혼합 :

두 개의 염화나트륨 용액을 혼합한다고 상상해보십시오. 하나는 60.0 mL 용액에 2.0 g / L 농도이고 다른 하나는 80 mL 용액 부피에 2.5 g / L입니다.
반응이 일어나지 않기 때문에 질량과 부피는 모두 초기 질량과 부피의 합입니다.
m (솔루션) = m1 (NaCl) + m2 (NaCl)
미디엄1 (NaCl) = v. 센티미터2 (NaCl) = v. 씨
미디엄1 (NaCl) = 0.06L. 2.0g / L · m2 (NaCl) = 0.08L. 2.5g / L
미디엄1 (NaCl) = 0.1gm2 (NaCl) = 0.2g
m (용액) = 0.1g + 0.2g
m (용액) = 0.3g
v (솔루션) = v1 (NaCl) + v2 (NaCl)
v (용액) = (60 + 80) mL
v (용액) = 140mL = 0.14L
다음 데이터를 사용하여 농도를 얻을 수 있습니다.
C (솔루션) = m (솔루션)
v (솔루션)
C (솔루션) = 0.3g
0.14L
C (솔루션)≈ 2.14g / L
2nd) 화학 반응이 발생하지 않는 다양한 용질의 용액 혼합 :
예를 들어 500ml의 자당 수용액 (C12H22영형11) 초기에 18.0 g / L의 농도를 가졌고, 100.0 g / L의 농도를 가진 1 L의 염수 용액 (염화나트륨 수용액 – NaCl)을 포함합니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
혼합 후, 혼합물에서 얻은 용액의 몰 농도, 공통 농도, 질량 및 부피는 얼마가 되었습니까?
화학 반응이 없었기 때문에 C의 질량은12H22영형11 그리고 NaCl은 변하지 않습니다. 그리고 초기 질량 값은 반응 농도를 사용하여 3의 간단한 규칙으로 얻을 수 있습니다.
18.0g 1L
m (C12H22O11) 0.5L
m (C12H22영형11) = 9.0g
m (NaCl) 100.0 지
질량은 다음 공식으로도 얻을 수 있습니다.
m = v. 씨
m (C12H22영형11) = 0.5L. 18g / L
m (C12H22영형11) = 9.0g
m (NaCl) = 1L. 100.0g / L
m (NaCl) = 100.0g
따라서 솔루션의 총 질량은 두 질량의 합입니다.
m (솔루션) = m (C12H22영형11) + m (NaCl)
m (용액) = 109.0g
볼륨은 단순히 초기 볼륨의 합계이므로 다음과 같습니다.
v (최종 솔루션) = v (C12H22영형11) + v (NaCl)
v (최종 솔루션) = (0.5 + 1) L
v (최종 솔루션) = 1.5L
최종 농도는 각 용질의 농도를 별도로 계산하여 달성됩니다. 그들은 서로 반응하지 않고 질량이 변하지 않기 때문에 다음 농도 공식을 사용할 수 있습니다.
C = 미디엄
V
초기 = m머리 글자 최종 c = m결정적인
V머리 글자 V결정적인
미디엄머리 글자 = m결정적인
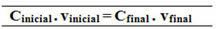
C (C12H22영형11) =?
씨머리 글자. V머리 글자 = C결정적인. V결정적인
18.0g / L. 0.5 L = C결정적인 .1.5 리터
C (C12H22영형11) 결정적인 = 6.0g / L
C (NaCl) =?
씨머리 글자. V머리 글자 = C결정적인. V결정적인
100.0g / L. 1L = Cfinal .1.5L
C (NaCl)결정적인 = 66.67g / L
이 공통 농도 공식에 대한 관계는 몰 농도 (M나는. V나는 = M에프. V에프) 및 질량 별 질량 농도 (Title-T나는. V나는 = T에프. V에프).
작성자: Jennifer Fogaça
화학 전공



