에서 공유 결합라고도 함 분자 또는 동극 결합, 원자 사이에서 발생하는 전기 음성 원소즉, 전자를받는 경향이 있으며, 원자가 껍질에서 전자를 공유합니다.
공유 결합은 다음 요소 사이에서 발생할 수 있습니다. 수소, 비금속 및 반 금속. 금속은 이러한 유형의 결합에 절대 참여하지 않습니다.
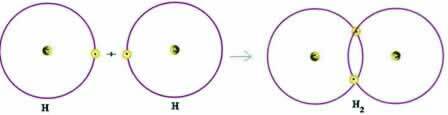
공유 결합의 간단한 예를 살펴 보겠습니다. 수소 가스 형성 결합 (H2):
H + H → H2
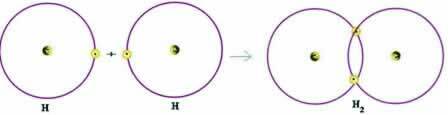
옥텟 규칙에 따라 원자가 껍질을 완성하기 위해 두 원자 모두 전자를 받아야하고, 이런 방식으로 안정을 유지해야합니다. 따라서 그들은 전자를 공유했고, 이런 식으로 둘 다 두 개의 전자를 가졌고 완전한 K- 쉘을 가졌으며 희가스 헬륨의 구성을 획득했습니다.
이러한 전자 공유는 이러한 유형의 결합을 전자 전달이 발생하는 이온 결합과 구별하는 것입니다.
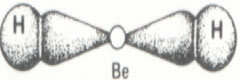
이 경우의 두 가지 추가 예는 아래 그림을 참조하십시오.
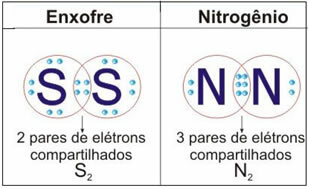
지금 멈추지 마세요... 광고 후 더 있습니다;)
이 유형의 결합에는 분자의 형성이 있으며, 이는 각각의 분자식즉, 분자에있는 각 원소의 원자 수를 나타내는 가장 간단한 표현입니다. 분자식의 몇 가지 예는 다음과 같습니다. H2, S2, O2, 아니2, H2O, CO2등
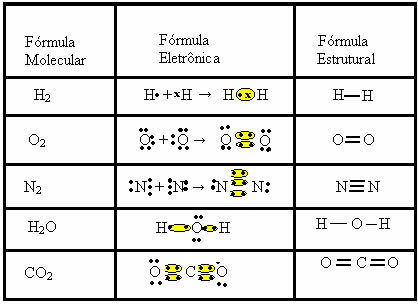
공유 결합은 두 가지 다른 공식으로 나타낼 수 있습니다.
- 전자식 또는 루이스 공식:이 공식에서 각 원자의 원자가 껍질의 전자와 전자 쌍의 형성이 나타납니다. 이 전자는 기호로 상징됩니다. . 또는 x;
- 플랫 구조 공식 또는 Couper 구조 공식: 각 공유 쌍이 대시에 해당하는 요소의 링크를 표시합니다. 대시 일 경우 단일 링크라고합니다. 두 개가 있으면 이중 결합; 대시가 세 개 있으면 삼중 결합입니다.
공유 결합의 다른 예는 다음 세 가지 화학식으로 표시됩니다.
작성자: Jennifer Fogaça
화학 전공
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
FOGAÇA, Jennifer Rocha Vargas. "공유 결합"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. 2021 년 6 월 27 일 액세스.