Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)는 이탈리아의 화학자로서 그램 단위의 질량이 원자 질량과 수치 적으로 동일한 원소의 샘플은 항상 동일한 수의 원자를가집니다. (엔).
Avogadro 자신은 N의 가치를 결정할 수 없었습니다. 그러나 20 세기에 걸쳐 기술과 과학 지식의 발전으로 다른 과학자들이 그것을 결정하는 기술을 개발할 수있게되었습니다. 이 값이 마침내 발견되었을 때 아보가드로 상수,이 과학자를 기리기 위해 창조의 기초를 닦은 사람이었습니다.

로렌조 로마노 아메데오 카를로 아보가드로 (1776-1856)
모든 개체 (원자, 분자, 전자, 공식 또는 이온)의 1 몰에는 Avogadro 상수 값이 정확히 포함되어 있습니다.
아래 표는 20 세기 동안 얻은 Avogadro 상수에 대한 몇 가지 값을 보여줍니다.
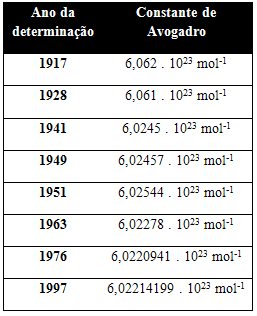
다음은 Avogadro 상수 값을 결정하는 데 사용되는 몇 가지 기술입니다.
Avogadro 상수를 대략적으로 계산 한 최초의 과학자는 Johann Joseph Loschmidt입니다. 1867 년에 그는 기체의 운동 이론에 기초하여 1cm에 얼마나 많은 분자가 존재하는지 결정했습니다.3 가스의.
또 다른 과학자는 프랑스 인 Jean Baptiste Perrin (1870-1942)으로 현탁액에서 단위 부피당 콜로이드 입자의 수를 세고 질량을 측정했습니다. 그가 찾은 값은 6.5에서 7.2 사이였습니다. 1023 몰당 엔티티. 이 과학자는 1913 년에 Les Atomes (1 판. Paris: Alcan)과 1924 년에 출판 된 9 판에는 Avogadro 상수를 실험적으로 구하는 16 가지 방법이 포함되어 있습니다.
이제 멈추지 마... 광고 후 더 있습니다 ;)

Jean Baptiste Perrin (1870-1942)
몇 년 후 과학자 James Dewar (1842-1923)는 방사 화학자 Bertram Boltwood (1870-1927)와 물리학 자 Ernest가 몇 년 전에 개발 한 방법을 사용했습니다. Rutherford (1871-1937)는 기본적으로 방사성 소스에서 방출되는 알파 입자를 세고 얻은 헬륨 가스의 부피를 결정하는 것으로 구성되었습니다. Dewar에서 찾은 값은 6.04입니다. 10
23 몰-1.20 세기에 Robert Millikan (1868-1953)은 전자의 전하 (1.6. 10-19 씨). 1 몰의 전자 전하가 이미 알려져 있기 때문에 (96500C),이 두 값을 연관시키고 Avogadro 상수에 대해 다음 값을 찾을 수있었습니다: 6.03. 1023 몰-1.
현재 Avogadro 상수에 대한 권장 값은 다음과 같습니다. 6.02214 x 1023 몰-1 그리고 X 선 회절에 의해 결정되는데, 여기서 결정 격자의 몇 원자의 부피는 샘플에서 원자 1 몰의 밀도와 질량이 알려져있는 한 얻어집니다.
교훈적인 목적을 위해 화학 실험실에서 수행 된 계산만큼 정확할 필요가없는 고등학교에서 Avogadro 상수는 다음과 같이 간주됩니다. 6,02. 1023 몰-1.
학생들이 실제로 Avogadro 상수를 결정하는 데 도움이되는 더 간단한 방법도 있습니다. 그들 중 하나는 수성 매질에서 전기 분해를 통한 것입니다.
작성자: Jennifer Fogaça
화학 전공
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
FOGAÇA, Jennifer Rocha Vargas. "Avogadro 상수의 결정"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. 2021 년 6 월 28 일 액세스.


