당신 탄화수소 에 의해 구성된다 탄소 (C) 및 수소 (H). 이 화합물의 주요 요소 인 탄소의 유연성은 매우 다양한 구조의 존재를 선호합니다 따라서 융점 및 비등점과 같은 일부 특성은 탄화수소마다 다를 수 있습니다.
그들은 대부분 분자입니다 무극성,와 함께 힘에스 분자간 유도 쌍극자 유형 및 밀도 이하 그만큼 물에서. 이러한 화합물의 식별은 국제 순수 및 응용 화학 연합 (Iupac)에서 정한 규칙을 따르는 명명법을 통해 수행 할 수 있습니다.
읽기: 탄소-우주에서 가장 풍부한 요소 중 하나
탄화수소의 특성

극성: 헤테로 원자가없는 탄화수소는 무극성.
분자간 힘: 탄화수소 분자 사이의 결합 유형은 유도 쌍극자.
융점 및비등: 분자의 크기, 기능 및 구조적 구성에 따라 다릅니다.
몸 상태: 정상적인 온도와 압력 조건에서 탄소 원자가 4 개 이하인 탄화수소는 기체 상태입니다. 탄소수 5 ~ 17 개는 액체 상태이고 탄소수 17 개 이상인 탄화수소는 고체 물질입니다.
밀도: 보다 작다 밀도 물, 즉 1.0 g / cm³ 미만.
반동: 지방족 및 불포화 탄화수소는 반응성이 낮습니다. 불포화 화합물은 다른 분자와 반응 할 가능성이 더 높으며 탄소가 최대 5 개인 사이 클릭 탄화수소는 반응성이 매우 높습니다.
탄화수소의 분류
탄화수소 체인의 구조적 구성에 따라 분류 될 수 있습니다. 그리고 시설에 의해.불포화 탄소 사이에 이중 (s) 또는 삼중 결합의 존재, 파이 유형 연결 (π). 이미 가지 그들은 더 큰 탄화수소 구조에 부착 된“가지”와 같습니다. 순환 사슬은 또한 가지 및 / 또는 불포화를 포함 할 수 있습니다. 폐쇄 사슬 탄화수소의 구조적 조직은 무엇보다도 사각형, 삼각형, 헥산과 같은 다각형을 형성합니다.
원자 배열과 관련하여 탄화수소는 정상 또는 분 지형 사슬을 가질 수 있습니다.
→ C 탄화수소법선, 선형 또는 직선: 끝이 두 개 뿐인 문자열이있는 것.

→ C 탄화수소싫어하다 분기: 끝이 두 개 이상인 체인이있는 것. 분기가 어디에 있고 무엇인지 알기 위해서는 메인 체인을 올바르게 선택하는 것이 중요합니다.
주쇄에는 모든 불포화 및 이종 원자 (있는 경우)가 포함되어야합니다. 만큼 잘 가장 많은 수의 연속 탄소. 메인 체인에 포함되지 않은 탄소는 가지입니다.예:

"폐쇄"와 관련하여 탄화수소는 폐쇄, 개방 또는 혼합 사슬을 가질 수 있습니다.
→ 사슬 탄화수소에스 폐쇄 또는 순환 : 원자가 순환, 다각형 또는 방향족 고리를 형성하는 사슬을 가진 것들 (교대로 불포화 된 폐쇄 탄화수소). 가지가 없으면 끝이 느슨하지 않습니다. 다각형의 각 정점은 탄소와 각각의 수소 결합제를 나타냅니다.
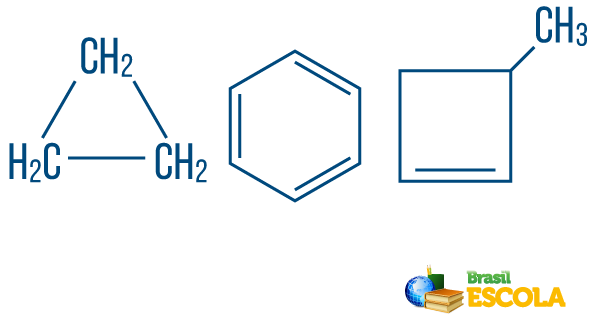
→ 개방 사슬 또는 비 환식 탄화수소 : 적어도 두 개의 끝이있는 사슬을 가진 것들입니다.

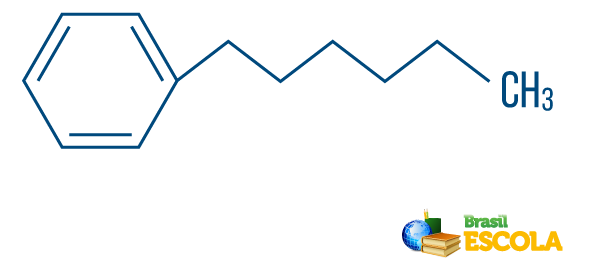
→ 탄화수소의 혼합 유형 문자열: 선형 부분에 부착 된 고리 또는 고리 사슬에 의해 형성되고; 적어도 한쪽 끝이 있습니다.
읽기: 방향족 탄화수소-예 및 특성
탄화수소의 명명법
각 탄화수소 유형에 대해 Iupac에서 설정 한 명명 규칙이 있습니다. 이 화합물의 명명법은 다음과 같이 수행됩니다.
1 부: 지점의 위치 및 이름 (있는 경우);
2 부: 용어 적용 주기 화합물이 닫힌 사슬이지만 지방족 (개방형) 사슬이라면 필요하지 않습니다.
3 부: 주 사슬에 얼마나 많은 탄소가 있는지를 나타내는 접두사;
4 부: 분자의 불포화 유형을 나타내는 위치 및 중위;
5 부: 탄화수소에 적합한 접미사 "o".
분자가 분지없이 열린 구조를 가지고 있다면 명명법은 3 부에서 시작됩니다.
다음 표는 일반적으로 탄화수소 명명법에 필요한 정보 (접두사, 접미사 및 접미사)를 보여줍니다. 영형 접두사 탄소의 수에 따라 다릅니다. 영형 중위, 불포화의 수에 따라; 그건 접미사“영형" 탄화수소 유형의 화합물을 나타냅니다.
접두사 |
중위 |
접미사 |
||
탄소 1 개 |
만났다 |
단일 통화 만 |
-an- |
-영형 |
탄소 2 개 |
et- |
|||
탄소 3 개 |
소품- |
이중 결합 1 개 |
-en- |
|
탄소 4 개 |
그러나- |
|||
탄소 5 개 |
갇힌- |
2 개의 이중 결합 |
-디엔- |
|
탄소 6 개 |
마녀- |
|||
탄소 7 개 |
hept- |
삼중 결합 1 개 |
-에- |
|
탄소 8 개 |
10 월 |
|||
9 개의 탄소 |
비 |
트리플 링크 2 개 |
-diin- |
|
탄소 10 개 |
12 월 |
유기 화합물의 명명법을 발견하는 첫 번째 단계는 메인 체인 식별 불포화와 가능한 한 많은 순차 탄소를 포함해야합니다. 메인 체인을 확인한 후 탄소는 열거되어야합니다 – 가지와 불포화 (있는 경우)에 가장 가까운 쪽에서 계산을 시작합니다. 그만큼 현지화 가지 또는 불포화가 발견되는 탄소의 수입니다. 때로는 라디칼 또는 이중 또는 삼중 결합의 가능한 위치가 하나뿐이므로 명명법에서 연결 탄소의 위치를 표현할 필요가 없습니다.

그만큼 분기에 대한 명명법 각각의 탄소 수와 종료로 제공됩니다. 선 또는 ll. 분기가 두 개 이상인 경우 알파벳 순서가 사용됩니다.
아래 예를 참조하십시오.
→ 예 1
CH3 – CH2 – CH3 → 프로판
첫 번째 부분: 접두사 "소품-”는 체인에 3 개의 탄소가 있음을 나타냅니다.
두 번째 부분: 중위 "-an-"분자가 유형의 연결 만 만든다는 신호 시그마 또는 간단합니다.
세 번째 부분: 접미사 "-영형”는 탄화수소의 특징입니다.
→ 예 2
CH2= CH-CH2-CH3 → But-1-ene
불포화 탄화수소에서는 쌍이있는 탄소의 번호를 매기고 위치를 찾아야하며 번호 매기기는 가능한 한 작아야합니다. 이를 위해 탄소 수는 이중 결합에 가장 가까운면에서 시작해야합니다.
첫 번째 부분: "그러나-" 사슬에 4 개의 탄소가 있음을 나타냅니다.
두 번째 부분: "1-en" 탄소 1과 2 사이에 위치한 불포화를 나타냅니다.
세 번째 부분: "-영형" 탄화수소의 특징적인 접미사입니다.
→ 예제 3

1 부 : "3- 에틸" 탄소 2에 탄소 2 개가 있다는 신호입니다.
두 번째 부분: "-갇힌-" 주 사슬에 5 개의 탄소가 있음을 나타냅니다.
세 번째 부분: "-안-" 불포화 사슬 (이중 또는 삼중 결합 없음)에 적용되는 중위입니다.
4 부: "-영형" 탄화수소의 특징적인 접미사입니다.
→ 예 4
체인 용 둘 이상의 지점, 사전 순으로 명명법에 라디칼을 배치합니다. 동일한 분자에 가지와 불포화가있는 경우 주쇄의 탄소 수는 위치 번호의 합이 가능한 한 적도록해야합니다.
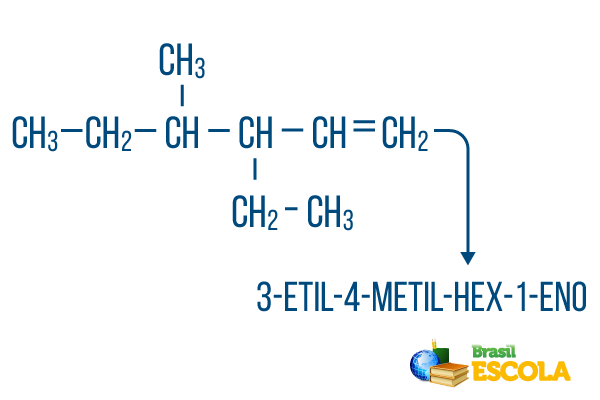
주쇄 탄소 수는 왼쪽에서 오른쪽으로 이루어졌으며 불포화 및 분기 위치 숫자의 합은 1 + 4 + 3 = 8입니다. 탄소 수가 오른쪽에서 왼쪽 이었다면 화합물 명명법은 다음과 같습니다. 4- 에틸 -3- 메틸 -5- 엔, 위치의 합계는 다음과 같습니다. 4 + 3 + 5 = 12, 다른 가설보다 크므로 사용해서는 안됩니다.
1 부: 3- 에틸 -4- 메틸 알파벳 순서와 각각의 위치에서 근본을 참조합니다.
두 번째 부분: 마녀- 메인 체인에 6 개의 탄소가 있음을 의미합니다.
세 번째 부분: 1-en 탄소 1에 이중 결합이 있음을 나타냅니다.
4 부: "-영형" 탄화수소의 특징적인 접미사입니다.
→ 예 5
닫힌 문자열의 경우 이름 지정 규칙이 유지되지만 주기 화합물의 이름을 시작하여 폐쇄 또는 고리 탄화수소임을 나타냅니다.
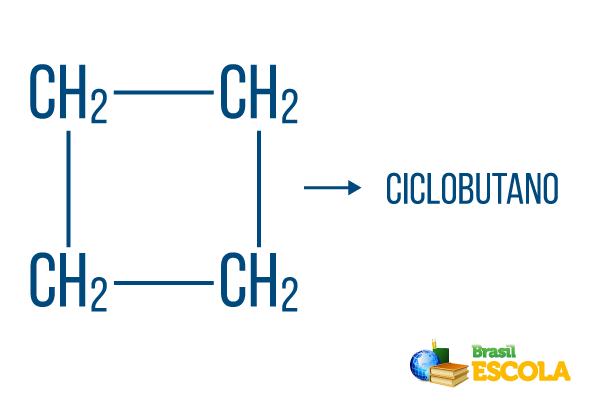
1 부: 주기- 닫힌 문자열임을 나타냅니다.
두 번째 부분: -그러나- 사슬에 4 개의 탄소가 있음을 나타냅니다.
세 번째 부분: -영형탄화수소의 특징적인 접미사입니다.
읽기: 탄소 사슬의 분류
탄화수소의 종류
탄화수소는 알칸, 알켄, 알킨 및 알카 디엔으로 나눌 수 있습니다. 사슬 (이중 결합 또는 삼중 결합)의 확립에 따라-사슬 인 사이클란 닫은.
→ 알칸 : 불포화도가없는 탄화수소입니다. 알칸의 일반 공식은 C입니다.아니H2n + 2, 그리고 아니징조 그것은 구성 접두사 + an + 영형.
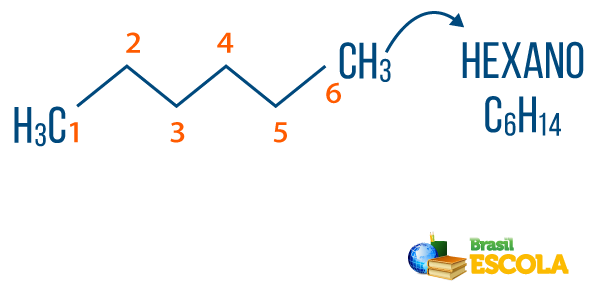
당신 알칸 자연에서 찾을 수 있습니다, 가스처럼 메탄 (CH4), 이는 동물에 의해 방출되고 분해 과정에서 생산되며 정제소 및 석유 화학 산업에서 생산됩니다. 같은 화합물 프로판 (씨3H7), 부탄 (씨4H10)는 요리 가스 (LPG)를 구성하고 옥탄 (씨8H18)는 자동차 연료에 존재하는 부산물입니다. 석유.

→ 알켄 또는 알켄: 불포화, 이중 결합을 갖는 탄소 사슬입니다. 일반 공식은 C입니다.아니H2n및 귀하 아니징조 그것은 구성 피수정 + ko + o.

영형 에틸렌 가스 (씨2H4), 과일의 숙성을 가속화하기 위해 농업에서 사용되는 기능에 속합니다. 알켄. 이 화합물은 원료 생산에도 사용됩니다. 폴리에틸렌, 플라스틱기구의 제조에 사용됩니다.
→ 알킨 또는 아세틸렌: 삼중 결합을 가진 탄화수소. 일반 공식은 C입니다.아니H2n-2. 그만큼 명명법 그것은 구성 접두사 + in + o.

영형 아세틸렌 또는 에틴 (C2H2)는 다음에 사용되는 알킨 기능의 가스입니다. 용접 및 금속 절단. 이 화합물은 최대 3,000 ° C의 온도에 도달 할 수있어 선박의 잠수 한 부분에서 수리를 수행 할 수 있습니다.

→ 알카디 엔 또는 디엔: 두 개의 불포화를 가진 탄소 사슬, 즉 탄소 사이에 두 개의 이중 결합. 이 함수의 일반 공식은 C입니다.아니H2n-2. 알킨과 동일한 공식이라는 것을 깨달으십시오. 이성질체 (다른 화합물에 대해 동일한 분자식).
알카 디엔의 명명법은 다음과 같이 구성됩니다. 피수정 + 디엔 + o.
예:

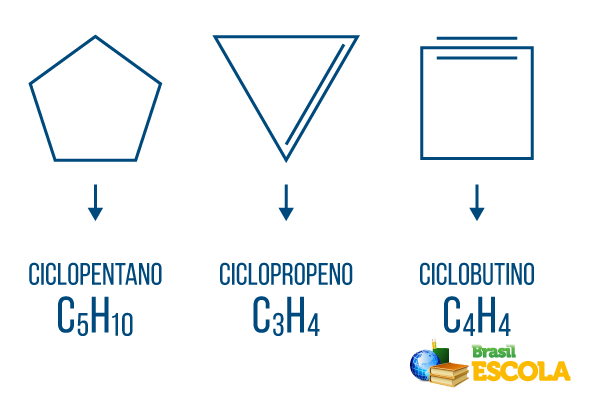
→ 폐쇄 사슬 탄화수소 : 분자는 순환적인 방식으로 조직화되고 다각형을 형성하는 경향이 있으며 열린 사슬에서와 같이 설정 및 / 또는 파급 효과가있을 수 있습니다. 사이클론, 사이클론, 사이클린 및 벤젠은 폐쇄 사슬 탄화수소입니다.
사이클론 또는 사이클로 알칸: 단일 결합만으로 구성된 고리 형 사슬. 일반 공식은 C입니다.아니H2n. 명명법: ciclo + 접두사 + an + o.
사이클 또는 사이클로 알켄: 시설이있는 폐쇄 탄화수소 사슬. 일반 공식은 C입니다.아니H2n-2. 명명법: 씨iclo + 접두사 + en + 영형.
-
사이클린 또는 사이클로 알킨: 두 개의 이중 결합이있는 폐쇄 사슬 탄화수소. 일반 공식은 C입니다.아니H2n-4. 명명법: 씨iclo + 접두사 + in + o.
벤젠
벤젠 폐쇄 사슬 탄화수소의 일종으로 6 개의 탄소 채권은 싱글과 더블 사이에서 다릅니다. 이 화합물은 독성 화학 공정에서 유기 용매로 사용되는 발암 성이 강합니다.
탄화수소가 방향족으로 간주 되려면 적어도 하나의 벤젠 고리, 반응성이 높으므로 두 개 이상 대체품, 우리는 여기에서 파급 효과로 볼 것입니다. 두 개의 연결 부수가있을 때, 우리는 각 위치 쌍에 대한 특정 이름을 갖게됩니다.
벤젠 1,2 탄소의 방사형 → 직교
벤젠의 1,3 탄소에서 라디칼 → 골
벤젠의 탄소 1,4 방사형 → ...에 대한
방향족 화합물의 명명법은 다음과 같이 수행됩니다.
첫 번째 부분: 리간드의 위치 (직교, 목표 또는).
두 번째 부분: 벤젠에 부착 된 라디칼의 이름 (메틸, 에틸, 프로필…). 라디칼에 주어진 이름은 다른 탄화수소의 규칙을 따릅니다.
- 세 번째 부분 : -비독, 방향족 탄화수소의 특징적인 용어입니다.
예 :
→ 오르토-디메틸-벤젠

1 부: 영형rto- 라디칼이 탄소 1과 2에 위치 함을 나타냅니다.
두 번째 부분: -디메틸- 둘 다 하나의 탄소를 가진 두 개의 라디칼을 의미합니다.
3 부 :-벤젠 방향족 탄화수소의 특징적인 용어입니다.
→ 오르토-에틸-메틸-벤젠
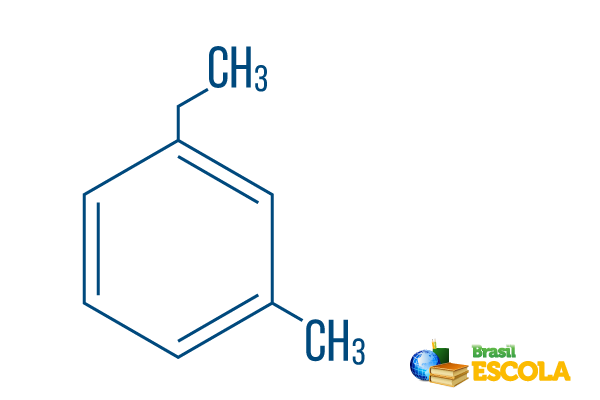
1 부: 미디엄오- 라디칼이 탄소 1과 3에 위치 함을 나타냅니다.
두 번째 부분: 에틸-메틸- 각 라디칼의 탄소 양을 의미하며 에틸 그만큼 탄소 2 개 지점 및 메틸 하나의 탄소로 분기 – 알파벳 순서로 명명법에 배치됩니다.
3 부 :-벤젠 방향족 탄화수소의 특징적인 용어입니다.
→ 파라디 에틸 벤젠
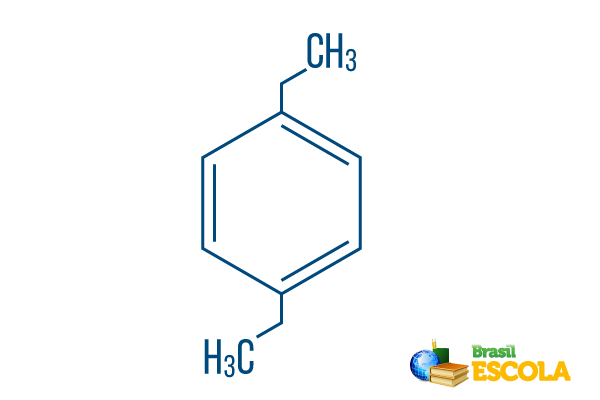
1 부: 피쟁기- 라디칼이 벤젠의 탄소 1과 4에 있음을 나타냅니다.
두 번째 부분: -디 에틸- 유형의 두 개의 라디칼을 참조합니다. 에틸, 즉, 각각 두 개의 탄소를 가진 두 개의 가지입니다.
3 부 :-벤젠 방향족 탄화수소의 특징적인 용어입니다.
읽기 :벤젠 구조 발견
해결 된 운동
(Unesp) – 옥탄은 탄화수소의 혼합물 인 가솔린의 주요 구성 성분 중 하나입니다. 옥탄의 분자식은 다음과 같습니다.
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
답: 편지 a). 화합물 명명법 분석 옥탄, 그것은 알칸, 즉 단일 결합으로 만 구성된 분자입니다. 알칸의 일반 공식이 C 인 경우아니H2n + 2, "n"을 8로 바꾸는데, 이는 주쇄에있는 탄소의 양인이 경우 고유합니다. 옥탄의 분자식은 C8H18입니다.
(UFSCar-SP) – 탄화수소에 대한 다음 설명을 고려하십시오.
I) 탄화수소는 탄소와 수소로만 구성된 유기 화합물입니다.
II) 직쇄 불포화 탄화수소 만 알켄이라고합니다.
III) 사이클로 알칸은 일반 식 CnH2n을 갖는 포화 지방족 탄화수소입니다.
IV) 방향족 탄화수소: 브로 모 벤젠, p- 니트로 톨루엔 및 나프탈렌.
다음 문장이 정확합니다.
a) I 및 III 만.
b) I, III 및 IV 만 해당.
c) II 및 III 만.
d) III 및 IV 만 해당.
e) I, II 및 IV 만 해당.
답: 편지 a).
II – 알켄은 이중 결합을 가진 화합물, 즉 불포화 화합물이지만, 독점적으로 선형이 아닌 사슬에 파급 효과를 가질 수 있습니다.
IV-Bromethobenzene 및 p-nitrotoluene 화합물은 다른 유기적 기능.
작성자: Laysa Bernardes
화학 교사
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm
