이온 결합은 이름에서 알 수 있듯이 이온 사이에서 발생합니다. 그들은 반대 전하를 가지기 때문에 양이온 (양전하를 가진 원소)과 음이온 (음전하를 가진 원소)이 서로 정전 기적으로 끌어 당겨 결합을 형성합니다. 그러나 이온 성 고체는 격자 또는 결정 격자라고하는 잘 정의 된 기하학적 모양으로 구성된 양이온과 음이온의 응집체로 구성됩니다.
예를 들어, 소금 (염화나트륨)은 전자가 나트륨에서 염소로 최종적으로 전달되어 나트륨 양이온 (Na+) 및 염화 음이온 (Cl-). 실제로이 반응은 두 개의 원자뿐만 아니라 아래 그림과 같이 입방체 모양의 결정 격자를 형성하는 엄청나고 불확실한 수의 원자를 포함합니다.
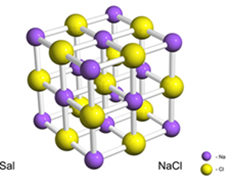
주사 전자 현미경으로 소금 결정을 보면, 내부 구조 때문에 실제로 입방체임을 알 수 있습니다.

그러면 모든 이온 화합물이 불확정하고 매우 많은 수의 이온으로 구성되어 있기 때문에 이온 화합물을 어떻게 나타낼 수 있습니까?
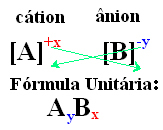
일반적으로 사용되는 공식은 단위 공식, 그것은 화합물의 총 전하가 중화되도록 결정 격자를 구성하는 양이온과 음이온의 가능한 최소 수로 표현되는 비율을 나타냅니다.. 이것이 일어나기 위해서는 원자가 포기한 전자의 수가 다른 원자가받는 전자의 수와 같아야합니다.
이온 화합물의 단위 식에 대한 몇 가지 측면이 중요합니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
- 항상 양이온을 먼저 쓴 다음 음이온을 쓰십시오.
- 모든 이온 화합물은 전기적으로 중성이므로 개별 이온 전하를 기록 할 필요가 없습니다.
- 각 이온의 오른쪽에 나타나는 아래 첨자 번호는 양이온과 음이온의 원자 비율을 나타냅니다. 이 숫자를 인덱스라고하며 숫자 1은 쓰지 않습니다.
예를 들어, 염화나트륨의 경우 각 염화물 음이온에 대해 정확히 1 개의 나트륨 양이온이 있으므로 단위 공식은 NaCl입니다.
다른 예보기, Al3+ 세 개의 양전하가있는 반면 F- 그것은 단지 하나의 부정적인 것을 가지고 있기 때문에 화합물을 중화시키기 위해서는 3 개의 불소 음이온이 필요합니다. 따라서 단위 공식은 AlF3.
이온 화합물의 단위 공식에 도달하는 간단한 방법은 아래의 일반적인 방법에 표시된 것처럼 전하를 인덱스로 교환하는 것입니다.
예 :

이온 성 물질을 나타내는 데 사용되는 또 다른 공식은 루이스 공식 또는 전자 공식, 뭐 요소 기호 주변의 "공"이온의 원자가 쉘에서 전자를 나타냅니다. 소금의 경우 :

작성자: Jennifer Fogaça
화학 전공
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
FOGAÇA, Jennifer Rocha Vargas. "이온 결합을 나타내는 공식"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm. 2021 년 6 월 28 일 액세스.
b) 불화 알루미늄 나트륨 공식에서 x의 값을 구하십시오.
이온 화합물, 이온 화합물의 주요 특징, 이온 간 결합, 전자의 확실한 전달, 이온, 음이온 및 양이온, 음이온, 양이온, 이온 결합, 분자 구조 사이의 정전기 인력 그
탄소의 공간 식, 루이스의 전자식, 평면 구조, 전자쌍, 결합 공유, 원자가 층, 원자 모델의 진화, 분자식, 구조식, 공식 3 차원.
화학식, 평면 구조식, Couper 구조식, 삼중 결합, 가스 질소, 전자식, 루이스 식, 분자식, 단일 결합, 이중 결합, 가스 탄소.
화학

이온 결합, 이온 화합물 간의 배열, 이온 응집체, 염화나트륨, 식염, 이온 물질, 정전기 인력, 염화물 음이온, 나트륨 양이온, 극성 용매, 양이온, 양이온, 음이온, 음이온.