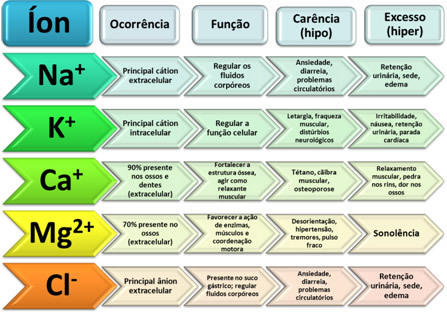
산화환원 반응의 주요 특징은 한 화학종이 동시에 전자를 잃고(산화에 의해) 다른 화학종이 환원에 의해 전자를 얻는다는 것입니다.
그러나 특정 반응에서는 산화 및/또는 환원만 있는 것이 아님을 관찰할 수 있습니다. 다음은 예입니다.
SnS + HCl + HNO3 → SnCl4 + S + 아니 + H2영형
이 반응에서 모든 원자의 산화수(Nox)를 계산하면 "산화수(Nox) 결정"이라는 텍스트에 설명되어 있습니다.
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + 아니 + H2영형
어떤 것들이 있는지 지금 확인해보자물질은 Nox에서 변형을 겪었고 결과적으로 산화 및 환원되었습니다.
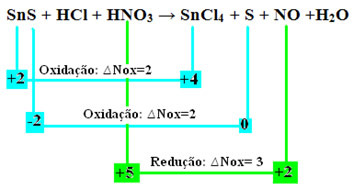
두 번의 산화가 발생했음을 유의하십시오. 그렇다면 화학 반응식의 균형을 맞추는 방법은 무엇입니까?
모든 산화환원 반응에 적용되는 한 가지 중요한 사항은 주어진 전자의 수는 항상 받은 전자의 수와 같아야 합니다.
따라서 이러한 유형의 반응의 균형을 유지하려면 텍스트에 설정된 동일한 규칙을 따르십시오.레독스 밸런싱" 그러나 단 한 번의 변경으로: 두 개의 산화(SnS)를 생성한 종의 Nox 변화(∆Nox)의 결정은 두 개의 ∆Nox의 합이 될 것이며, 이는 손실된 전자의 총 값을 제공할 것입니다.
- SnS: ∆총 Nox = (∆Nox SnCl4) + (∆녹스 S)
SnS: ∆총 NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
따라서 밸런싱을 위해 다음 단계를 진행할 수 있습니다.
이제 멈추지 마... 광고 후 더 있습니다 ;)
- SnS: ∆총 NOx = 4 → 4 HNO 계수가 될 것입니다3;
- HNO3: ∆녹스 = 3 → 3 SnS의 계수가 됩니다.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + 아니 + H2영형
시도 방법으로 계속 균형 조정:
- 첫 번째 구성원에 3개의 Sn과 3개의 S가 있으므로 두 번째 구성원의 계수도 됩니다.
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+NO+H2영형
- 이로써 2번째 멤버는 12Cl(3. 4 = 12)이므로 12는 첫 번째 구성원인 HCl에서 Cl이 발견되는 물질의 계수가 됩니다.
3 SNS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +H2영형
- 이제 첫 번째 멤버(12 + 4 = 16)에 16개의 H가 있으므로 H의 계수는2O는 8과 같을 것입니다. 8에 수소 지수 2를 곱하면 16이 되기 때문입니다.
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 아니요 +8시간2영형
- 또한 첫 번째 멤버에는 4N도 있으므로 4는 두 번째 멤버에서도 N의 계수가 됩니다.
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2영형
첫 번째 사지의 산소량(3. 4 = 12)는 두 번째 다리에 있는 해당 요소의 총량(4 + 8 = 12)과 같습니다. 따라서 반응이 균형을 이룹니다.
제니퍼 포가사
화학과 졸업
학교나 학업에서 이 텍스트를 참조하시겠습니까? 바라보다:
포가아, 제니퍼 로샤 바르가스. "하나 이상의 산화 및/또는 환원 반응"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. 2021년 7월 27일에 확인함.