ელექტროლიზი არის ქიმიური ინდუსტრიის მიერ ფართოდ გამოყენებული პროცესი, რადგან მისი მიღება საშუალებას იძლევა ნივთიერებები, რომლებიც ბუნებაში არ არსებობს, როგორიცაა ქლორი, იოდი, კასტიკური სოდა სხვები
ელექტროლიზი უჯრედის საპირისპიროა, რომელშიც ელექტროენერგია მიიღება რედოქს რეაქციების საშუალებით, ანუ ქიმიური ენერგია გარდაიქმნება ელექტრულ ენერგიად. უკვე ელექტროლიზის დროს ელექტროენერგია გამოიყენება რედოქს რეაქციების და ქიმიური ენერგიის წარმოსაქმნელად.
აქედან გამომდინარეობს მისი სახელის წარმოშობა ელექტრო ნიშნავს "ელექტროენერგიას" და ლიზისი ნიშნავს "შესვენებას". ეს ზუსტად ის ხდება, ელექტრული მიმდინარეობა არღვევს ან ანადგურებს მასზე დაქვემდებარებულ ნივთიერებას.
ელემენტი არის სპონტანური პროცესი, ელექტროლიზი, თუმცა, ეს არის არა სპონტანური პროცესი, რომლის დაწყება საჭიროა ელექტროენერგიის საშუალებით.
არსებობს ელექტროლიზის ორი ტიპი: ა ცეცხლოვანი და წყალში. ამ ტექსტში ჩვენ განვიხილავთ პირველ შემთხვევას.
წყალმცენარეებში ცეცხლოვან ელექტროლიზსა და ელექტროლიზს შორის განსხვავება არის ფორმა, რომელშიც არის ნივთიერება, რომელიც დაექვემდებარება ელექტროენერგიას.
ანთებული ელექტროლიზის შემთხვევაში, იონური ნივთიერება თხევად მდგომარეობაშია, ანუ გამდნარია, წყლის არსებობის გარეშე. სიტყვა "ცეცხლოვანი" ლათინურიდან მოდის ცეცხლოვანი, რაც ნიშნავს "წვას, ანთებას".ელექტროლიზის დროს გამოიყენება კონტეინერი, რომელსაც ეწოდება a კუბა ან ელექტროლიტური უჯრედი, სადაც დამონტაჟებულია ორი ელექტროდი, რომლითაც ელექტროენერგია გაივლის. ელექტროდები შეიძლება იყოს ინერტული (არ შეიცვალოს ელექტროლიზის დროს) ან აქტიური (ელექტროლიზის დროს ისინი განიცდიან გარკვეულ ცვლილებებს). ყველაზე მეტად გამოყენებულია პლატინის ან გრაფიტის შემავსებლები.
შემდეგ ელექტროდები უკავშირდება პირდაპირი დენის წყაროს (ელემენტს ან აკუმულატორს). აკუმულატორის უარყოფითი პოლუსი ელექტრონებს მიაწოდებს ერთ ელექტროდს, გახდება უარყოფითად დამუხტული და მოიზიდავს კატიონებს (დადებით იონებს) გამდნარი ნივთიერებისაგან. რადგან ის იზიდავს კატიონებს, ამ უარყოფით ელექტროდს კათოდს უწოდებენ. მასში კათიონები იღებენ ელექტრონებს და ამცირებენ.
პოზიტიური ელექტროდი იზიდავს ანიონებს (უარყოფით იონებს) და, ამის გამო, მას ანოდს უწოდებენ. ანიონები თავიანთ ელექტრონებს ანოდში ახდენენ, იჟანგება.
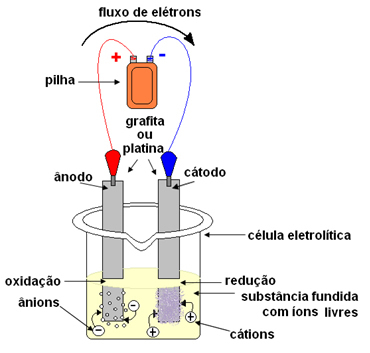
ბატარეებში დადებით ელექტროდს კათოდს უწოდებენ, ხოლო უარყოფითს - ანოდი. აქ ელექტროლიზის დროს პირიქითაა, ანოდი არის პოზიტიური პოლუსი და კათოდი არის უარყოფითი პოლუსი. ამასთან, ორივე შემთხვევაში, აკუმულატორში და ელექტროლიზში, ანოდში ხდება დაჟანგვა, ხოლო კათოდში - შემცირება.
მოკლედ, გვაქვს:

კიდევ ერთი მნიშვნელოვანი ფაქტია, რომ ელემენტს ან ბატარეას, რომელიც გამოიყენება ელექტროენერგიის წარმოქმნისთვის, უნდა ჰქონდეს ddp (პოტენციური სხვაობა) ტოლი ან მეტი, ვიდრე რეაქციის პოტენციური განსხვავება.
უკეთ რომ გავიგოთ როგორ ხდება ელექტროლიზის პროცესი და როგორ იშლება მნიშვნელოვანი ელემენტების ან მარტივი ნივთიერებების გამომუშავებელი ნივთიერებები, წაიკითხეთ ტექსტი წყალბადის ნატრიუმის ქლორიდის ელექტროლიზი.
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm

