მჟავები არის ნივთიერებები, რომლებიც იონიზირება წყალში და კარგია კონდუქტორები ძალა. ნივთიერების მჟავიანობის გაზომვა შესაძლებელია წყალბადის იონური პოტენციალის გაზომვის ტექნიკის გამოყენებით (pH) ხსნარის. ზოგიერთი pH ანალიზური მეთოდი იყენებს ინდიკატორებს, როგორიცაა ლაკმუსი ან ფენოლფთალინი, რომლებიც ასახავს ფერადი ხსნარის pH მნიშვნელობას.
მჟავების დახასიათება შეიძლება:
მის მოლეკულაში ჟანგბადის არსებობით ან არა;
ძალით;
იონიზებადი წყალბადებით;
თავისი არასტაბილურობით.
წაიკითხეთ ასევე:შედარება მჟავებსა და ბაზებს შორის - განსხვავებები და თვისებები
მჟავების მახასიათებლები
ისინი იონიზდებიან წყალმცენარეში და ათავისუფლებენ H კატიონს+.
ისინი ელექტროენერგიის გამტარია, გამოყოფის გამო იონები წყალში.
ძირითადი გარემოსთან კონტაქტის დროს ისინი განიცდიან ნეიტრალიზაციის რეაქცია, მარილისა და წყლის წარმოქმნა, როგორც ამ რეაქციის პროდუქტები.
ისინი ხსნიან ხსნარის ფერს ისეთი მაჩვენებელი ნივთიერების არსებობისას, როგორიცაა ლაკმუსი ან ფენოლფთალინი.
ლიმონის, ფორთოხლის მჟავე არომატი, სხვა ციტრუსების გარდა, გამოწვეულია ამ საკვებში არსებული მჟავით.
წყალბადის პოტენციალი (pH)
წყალბადის იონის პოტენციალი (pH) არის გაანგარიშება, რომელიც გამოხატავს იონის კონცენტრაცია წყალბადის გარკვეულში გამოსავალი. PH განსაზღვრისა და მედიის ანალიზისთვის გათვალისწინებულია შემდეგი:
ოსტვალდის განზავების კანონი (რაც უფრო გაზავდება, მით მეტი იონი წარმოიქმნება ხსნარში);
წყლის ავტოონიზაცია (კვტ), რაც H მოლეკულის ბუნებრივი დაშლაა2O H იონებში+ და ოჰ-;
გამოხდილ წყალს 25 ° C ტემპერატურაზე აქვს აუტიონიზაცია Kw = 10-14 და H იონების იგივე კონცენტრაცია+ და ოჰ-, ეს არის ნეიტრალური საშუალება.
PH– ის გამოსათვლელად H კონცენტრაციის ჩათვლით+, გამოყენება: pH = -log [H+].
Ვიცი, რომ:
pH> 7 → ძირითადი ხსნარი
pH <7 → მჟავე ხსნარი
pH = 7 ან pH = pOH → ნეიტრალური ხსნარი
იხილეთ აგრეთვე: როგორია მჟავა ფორმულები?

მჟავების კლასიფიკაცია
მჟავების კლასიფიკაცია შეიძლება გაკეთდეს ოთხი განსხვავებული კრიტერიუმის გათვალისწინებით.
იონიზაციის ხარისხი (α) ან მჟავა სიძლიერე
α = იონიზირებული მოლეკულების რაოდენობა
გახსნილი მოლეკულების რაოდენობა
ძლიერი მჟავები: α ≥ 50%.
მაგალითი: áმჟავა გოგირდოვანი (ჰ2მხოლოდ4) → α = 61%.ნახევრად ძლიერი ან ზომიერი მჟავები: 5% < α < 50%.
მაგალითი: ფოსფორის მჟავა (H3მტვერი4) → α = 27%.სუსტი მჟავები: α ≤ 5%.
მაგალითი: ბორის მჟავა (H3BO3) → α = 0,075%.
იონიზებადი წყალბადის რაოდენობა
მონოციდი: ათავისუფლებს H კატიონს+.
მაგალითი: áმჟავა მარილწყლოვანი (HCL);
დიაციდი: ათავისუფლებს ორ H კატიონს+.
მაგალითი: წყალბადის სულფიდი (H2ს)ტრიასიდი: ათავისუფლებს სამ H კატიონს+.
მაგალითი: ბორის მჟავა (H3BO3).ტეტრაციდი: ათავისუფლებს ოთხ H კატიონს+.
მაგალითი: პიროფოსფორული მჟავა (H4პ2ო7).
ყურადღება! ჰიდრაციდების შემთხვევაში, მოლეკულის ყველა წყალბადის არის ionizable; ოქსიაციდების შემთხვევაში, მხოლოდ წყალბადები, რომლებიც ჟანგბადის ატომთან არიან დაკავშირებული, იონიზირებადი. ამის მაგალითია ჰიპოფოსფორის მჟავა (H3მტვერი2), რომელიც არის მონომჟავა, რადგან, მისი შემადგენლობაში სამი წყალბადის არსებობის მიუხედავად, იგი მხოლოდ ათავისუფლებს წყალბადს, რომელიც ჟანგბადი.
ჟანგბადის არსებობა
ოქსიაციდები: აქვთ სტრუქტურა ჟანგბადს.
მაგალითი: ჰიპოქლორიუმის მჟავა (HO Cl).
ჰიდრაციდები: მათ სტრუქტურაში არ არის ჟანგბადი.
მაგალითი: ჰიდროფლორმჟავა (HF).
→ არასტაბილურობა
დაფიქსირდა: დუღილის წერტილი(ფეხები) > 100 ° C, ნელა იცვლება გაზურ მდგომარეობაში.
მაგალითი: გოგირდმჟავა (H2მხოლოდ4) → PE = 340 ° C.აქროლადი: დუღილის წერტილი <100 ° C, სწრაფად და მარტივად იცვლება გაზურ მდგომარეობაში.
მაგალითი: წყალბადის სულფიდი (H2S) → PE = -59,6 ° C.
მჟავების ნომენკლატურა
ჰიდრაციდები
მჟავა + ანიონის სახელი + ჰიდრიკა
ყველა მჟავასთვის ტერმინი "მჟავა" გამოიყენება იმ ნომენკლატურის წინ, რომელიც ახასიათებს მოლეკულას. ჰიდრაციდებში ელემენტის სახელის სუფიქსი "eto" შეიცვალა "hydric" - ით.
მაგალითები:
HCl მჟავა ქლორიწყალმცენარე
HBr მჟავა ბრომიწყალმცენარე
HF მჟავა ფტორიწყალმცენარე
→ ოქსიაციდები
ოქსიაციდების ნომენკლატურა იცვლება მიხედვით დაჟანგვის ნომერი (NOX) ცენტრალური ელემენტის. იხილეთ ცხრილი ქვემოთ:
ცენტრალური ელემენტის NOX |
მჟავების ნომენკლატურა |
||
პრეფიქსი- |
-ინფექსი- |
-სუფიქსი |
|
+1 და +2 |
ჰიპო- |
-ანიონის სახელი- |
-ოსო |
+3 და +4 |
-- |
ანიონის სახელი- |
-ოსო |
+5 და +6 |
-- |
ანიონის სახელი- |
-იკი |
+7 |
პერ |
-ანიონის სახელი- |
-იკი |
მაგალითები:
HClO იმის ცოდნა, რომ წყალბადს (H) ჩვეულებრივ აქვს NOX +1 და ჟანგბადს (O) აქვს NOX -2, იმისთვის, რომ გვქონდეს 0 მუხტის მოლეკულა, ქლორს (Cl) უნდა ჰქონდეს NOX +1, ამიტომ ამ მჟავას ნომენკლატურა არის ჰიპოქლორიუმის მჟავა.
HNO2 → აზოტის მჟავა
HClO4 →áმჟავაპერქლორიული
→ გამონაკლისი წესი
H2CO3 → ნახშირმჟავა, და არა ნახშირბადოვანი, როგორც ეს იქნებოდა NOX– ის წესით.
ჰ3BO3 → áმჟავა ბორის, და არა ბორული.
მჟავები ყოველდღიურ ცხოვრებაში
სასუქები და მედიკამენტები: ფოსფორის მჟავა (H3მტვერი4) ფართოდ გამოიყენება სასუქების წარმოებაში და აგრეთვე, როგორც წამალი. ეს არის ერთ – ერთი მჟავა, რომელიც გამოიყენება ფარმაცევტულ სფეროში.
Ციტრუსი: აქვს ასკორბინის მჟავა (C6ჰ8ო6), ასევე ცნობილია, როგორც Ვიტამინი ცე.
ძმარი: აქვს თავისი შემადგენლობით ძმარმჟავა (CH3COOH).
- ცქრიალა წყალი და გამაგრილებელი სასმელები: ნახშირმჟავასგან შედგება (H2კომპანია3), რაც პროდუქტს გამამხნევებელ სენსაციას ანიჭებს.
აგრეთვე წვდომა:მჟავების როლი გამაგრილებელ სასმელებში

ამოხსნილი სავარჯიშოები
Კითხვა 1 - (Enem) წითელი კომბოსტოდან მოპოვებული წვენი შეიძლება გამოყენებულ იქნას როგორც მჟავას ხასიათის მაჩვენებელი (pH 0-დან 7-მდე) ან ძირითადი (pH 7-დან 14-მდე) სხვადასხვა ხსნარისთვის. კომბოსტოს მცირე წვენისა და ხსნარის შერევით, ნარევი იწყებს სხვადასხვა ფერის ჩვენებას, მისი მჟავე ან ძირითადი ბუნების შესაბამისად, ქვემოთ მოცემული მასშტაბის შესაბამისად.
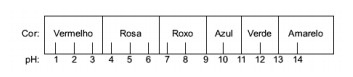
ზოგიერთი გამოსავალი შემოწმდა ამ ინდიკატორთან, შემდეგ შედეგებს:
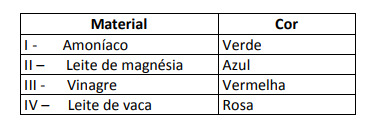
ამ შედეგების მიხედვით, I, II, III და IV გადაწყვეტილებებს, შესაბამისად, აქვთ შემდეგი ხასიათი:
ა) მჟავე / ფუძე / ფუძე / მჟავე.
ბ) მჟავა / ფუძე / მჟავა / ფუძე.
გ) ძირითადი / მჟავე / ფუძე / მჟავე.
დ) მჟავა / მჟავა / ფუძე / ფუძე.
ე) ძირითადი / ძირითადი / მჟავა / მჟავა.
რეზოლუცია
ალტერნატიული ე. იმის დასადგენად, აქვს თუ არა ნივთიერებას მჟავე, ძირითადი ან თუნდაც ნეიტრალური ხასიათი, ტარდება ტესტში მიღებული ფერების ანალიზი მოცემული მასშტაბის მონაცემებთან მიმართებაში. ვიცით, რომ pH = 7 ხსნარები ნეიტრალურია, pH> 7 არის ძირითადი და pH <7 მჟავეა დასკვნა, რომ მაგნიუმის ამიაკი და რძე ძირითადი ნივთიერებებია, ძმარი და ძროხის რძე მჟავები
კითხვა 2 - (PUC- ბანაკი) იმ ნივთიერებების შესახებ, რომლებიც მჟავებს უწოდებენ, სტუდენტმა აღნიშნა შემდეგი მახასიათებლები:
მე - მაქვს კოროზიული ძალა;
II - შეუძლიათ ბაზების განეიტრალება;
III - შედგება ორი ქიმიური ელემენტისგან;
IV - შექმნას წყალხსნარები, რომლებიც ახდენენ ელექტროენერგიის მიმდინარეობას.
მან მხოლოდ შეცდომები დაუშვა
ა) I და II
ბ) I და III
გ) I და IV
დ) II და III
ე) III და IV
რეზოლუცია
ალტერნატივა B. ყველა მჟავა კოროზიული არ არის, მხოლოდ ყველაზე ძლიერია და მჟავები შეიძლება შედგებოდეს ორი ან მეტი ატომისგან.
ლაიზა ბერნარდესის მიერ
ქიმიის მასწავლებელი

