იდეები მატერიის კონსტიტუციის შესახებ (ატომი) გაჩნდა ძველ საბერძნეთში, ძვ. ძირითადად, დემოკრიტოსა და ლეიციპოდან. ამასთან, ატომმა რეალურად მიიღო მხოლოდ სამეცნიერო ხასიათი მას შემდეგ, რაც ე.წ. დალტონის ატომური თეორია.
დალტონის ატომური თეორია ეს ფუნდამენტური იყო ატომური ცოდნის განვითარებისათვის, რადგან იგი საფუძვლად უდევს სხვა მეცნიერებს, რომ იცოდნენ ატომი და მისი მახასიათებლები.
Ვინ იყო ჯონ დალტონი?
ტრენინგით ქიმიკოსი ჯონ დალტონი დაიბადა კემბრიაში, ინგლისში, 1766 წელს და გარდაიცვალა მანჩესტერში 1844 წელს. ადრეული ასაკიდანვე განისაზღვრა მისი ცხოვრება სამეცნიერო კვლევებისა და სწავლებისთვის, იმდენად, რამდენადაც ასწავლიდა ან ხელს უწყობდა ცოდნის სხვადასხვა სფეროების განვითარებას.
მისი უდიდესი მემკვიდრეობა, როგორც მეცნიერი, პირველი ატომური თეორიის შემუშავება იყო. დალტონის ატომური თეორია გაჩნდა 1808 წელს, გაზების შერევასთან და ლავუაზიეს მიერ შემოთავაზებული სამუშაოების ცოდნასთან დაკავშირებული რამდენიმე ექსპერიმენტის საშუალებით.
დალტონის ატომური თეორიის პოსტულატები
დალტონის ატომური თეორია ემყარებოდა ექსპერიმენტებს, მაგრამ არც ერთ ამ ექსპერიმენტს არ შეეძლო ატომის გარკვევა. აქედან გამომდინარე, დალტონმა ატომს უწოდა მატერიის ყველაზე პატარა ნაწილი.
დალტონის თეორიაში გაცილებით მეტი პოსტულატია წარმოდგენილი ვიდრე მტკიცებულებები. იხილეთ ზოგიერთი მათგანი:
ატომები მასიური და სფერული ფორმისაა (ბილიარდის ბურთის მსგავსი);
ატომები განუყოფელია;
ატომები არღვევს;
ერთი ქიმიური ელემენტი ეს არის ატომების ერთობლიობა იგივე თვისებებით (ზომა და მასა);
სხვადასხვა ქიმიური ელემენტის ატომებს განსხვავებული თვისებები აქვთ ერთმანეთისგან;
ორი დიაპაზონის ნათესავი წონის გამოყენება შესაძლებელია მათი დიფერენცირებისთვის;
რთული ქიმიური ნივთიერება წარმოიქმნება სხვადასხვა ტიპის ატომების იგივე კომბინაციით;
სხვადასხვა ქიმიური ნივთიერებები წარმოიქმნება სხვადასხვა ატომის შერწყმით.
დალტონის ატომური მოდელის წარმომადგენლები
დალტონმა თავის ატომურ მოდელს ბილიარდის ბურთი დაარქვა და, ამრიგად, დაიწყო სფერული სიმბოლოების საშუალებით მის დროში ცნობილი ელემენტების ატომების წარმოდგენა.
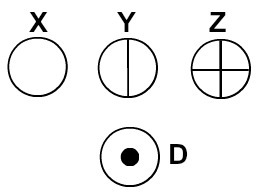
ატომები წარმოდგენილია დალტონის ატომური თეორიის შესაბამისად
თითოეული ატომური წარმოდგენა, რომელსაც აქვს კონკრეტული დეტალი, მიუთითებს განსხვავებულ ქიმიურ ელემენტზე. დიდაქტიკურად დაწყებითი და საშუალო დონის წიგნები და სავარჯიშოები ატომებს მხოლოდ სხვადასხვა ფერის სფეროების მიხედვით წარმოადგენენ.
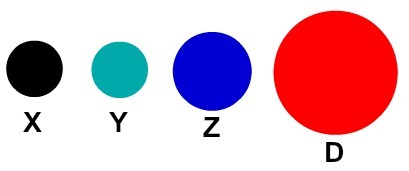
ატომების დიდაქტიკური წარმოდგენა
დალტონის ატომური თეორიის წვლილი
გაგება ლავუაზიეს კანონი მასის შენარჩუნების შესახებ
ფრანგმა ქიმიკოსმა ლავუაზიემ 1785 წელს განაცხადა, რომ ”ქიმიური რეაქციის დროს, მასა შენარჩუნებულია, რადგან ატომების არც შექმნა და არც განადგურება ხდება ”. დალტონის ატომურმა თეორიამ დაადასტურა ეს ფაქტი, რადგან მის ერთ-ერთ პოსტულატში ნათქვამია, რომ ატომი განადგურებულია.
ამიტომ, თუ ჩვენ ვაწარმოებთ ნახშირის (C) წვას ჟანგბადის გაზის თანდასწრებით (O2), ჩვენ გვექნება ქიმიური რეაქცია ერთ ნახშირბადის ატომსა და ორ ჟანგბადის ატომს შორის. ამ რეაქციით წარმოიქმნება ნახშირორჟანგი (CO2), რომელსაც აქვს ზუსტად იგივე ატომები, რომლებიც ქმნიდნენ ნივთიერებებს რეაქციამდე.
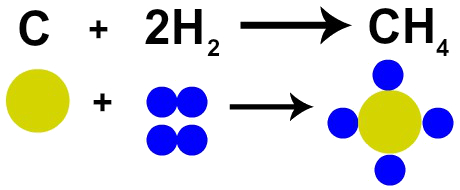
ლავუაზიეს კანონის წარმოდგენა დალტონის ატომური მოდელის მიხედვით
გაგება მარტივი ნივთიერებები
Გამოყენებით დალტონის ატომური მოდელი, ჩვენ შეგვიძლია გავიგოთ მარტივი ნივთიერება, ანუ ის, რომელსაც აქვს იგივე მახასიათებლის ატომები, რომლებიც ქმნიან მოლეკულას. ამიტომ, ჩვენ გვაქვს იგივე ქიმიური ელემენტის კუთვნილი ატომები.
F ნივთიერებაში2მაგალითად, ფტორის ორი ატომი გვაქვს, ამიტომ დალტონის ატომური თეორიის თანახმად, რეპრეზენტაციაში უნდა გამოვიყენოთ ორი სახის თანაბარი ატომი.

მარტივი ნივთიერების წარმოდგენა შესაბამისად დალტონის ატომური მოდელი
გაგება რთული ნივთიერებები
რთულ ნივთიერებაში გვაქვს სხვადასხვა მახასიათებლის ატომები, რომლებიც ქმნიან მოლეკულას. ამიტომ, ჩვენ გვაქვს სხვადასხვა ქიმიური ელემენტები, რომლებიც ქმნიან ნივთიერებას.
ნივთიერება H2მაგალითად, O– ს აქვს სამი ატომი: ორი წყალბადის და ერთი ჟანგბადის. იხილეთ მისი წარმოდგენა დალტონის ატომური მოდელის მიხედვით:
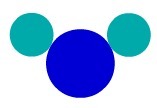
ნაერთი ნივთიერების წარმოდგენა კანის შესაბამისადდალტონის ატომური მოდელი
ნარევების გაგება
დალტონის ატომური თეორიის საშუალებით ნარევის (ორი ან მეტი სხვადასხვა ნივთიერების გაერთიანება) გაგება მარტივია: უბრალოდ ჩადეთ ორი სხვადასხვა მოლეკულა ერთ ჭურჭელში.

მეორე ნარევის წარმოდგენა დალტონის ატომური მოდელი
ჯონ დალტონის სხვა სამეცნიერო წვლილი
შემოიღო კონცეფცია ატომური მასა;
ჩამოყალიბებულია გაზების ნაწილობრივი წნევის კანონი (დალტონის კანონი);
აღმოაჩინა მხედველობის დაქვეითება ე.წ. ფერის სიბრმავე;
შეისწავლა ორთქლისა და გაზების ქცევა სხვადასხვა ტემპერატურაზე;
მან დაადგინა, რომ ყველა გაზები ერთნაირად ფართოვდება (ისინი ცდილობენ გარკვეული ადგილის დაკავებას) სივრცეში.
ჩემ მიერ. დიოგო ლოპეს დიასი
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm