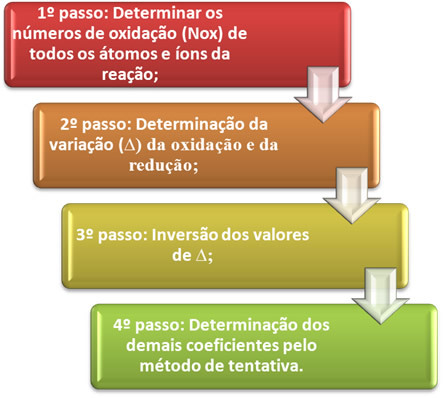
ო ჟანგვის შემცირების განტოლების დაბალანსება ეს ემყარება გაცემული ელექტრონების რაოდენობას და მიღებული ელექტრონების რაოდენობას. ამ დაბალანსების შესრულების მარტივი მეთოდი მოცემულია შემდეგი ნაბიჯებით:
მოდით ვნახოთ პრაქტიკაში როგორ უნდა გამოიყენოთ ეს ნაბიჯები შემდეგი მაგალითის გამოყენებით:
რეაქცია კალიუმის პერმანგანატის წყალხსნარსა და მარილმჟავას შორის:
კმ.ნ.4 + HCl → KCl + MnCl2 + კლ2 + თ2ო
*1-ლი ნაბიჯი:დაადგინეთ დაჟანგვის რიცხვები:
ეს ნაბიჯი მნიშვნელოვანია, რადგან, როგორც წესი, ჩვენ არ შეგვიძლია სწრაფად წარმოვიდგინოთ, რომელი სახეობები განიცდიან დაჟანგვას და შემცირებას.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
კმ.ნ.4 + HCl → KCl + MnCl2 + კლ2 + თ2ო
*მე -2 ნაბიჯი:ჟანგვის და შემცირების ვარიაციის განსაზღვრა:

გაითვალისწინეთ, რომ მანგანუმი (Mn) მცირდება და ქლორი (Cl) იჟანგება.
MnCl2 = OxNox = 5
კლ2 = OxNox = 2
ქლორის შემთხვევაში შეგვიძლია აღვნიშნოთ, რომ HCl წარმოქმნა 3 ნაერთი (KCl, MnCl)2და Cl2), მაგრამ რაც გვაინტერესებს არის Cl2, რადგან ეს არის თქვენი Nox, რომელმაც განიცადა ვარიაცია. თითოეული ქლორი, რომელიც ქმნის Cl
2 დაკარგოს 1 ელექტრონი; რადგან თითოეული Cl– ს წარმოქმნას სჭირდება 2 ქლორი2, შემდეგ ორი ელექტრონი დაიკარგა.მე -3 ნაბიჯი:∆ მნიშვნელობების ინვერსია:
ამ ეტაპზე the მნიშვნელობები იცვლება აღნიშნულ სახეობებს შორის და ხდება მათი კოეფიციენტები:
MnCl2 = OxNox = 5 → 5 იქნება Cl- ის კოეფიციენტი2
კლ2 = OxNox = 2→ 2 იქნება MnCl კოეფიციენტი2
კმ.ნ.4 + HCl KCl + 2 MnCl2 + 5 კლ2 + თ2ო
ამ ეტაპზე უკვე შესაძლებელია განტოლების ორი კოეფიციენტის ცოდნა.
დაკვირვება: ჩვეულებრივ, უმეტეს რეაქციებში, მნიშვნელობების ეს უკუგდება ხორციელდება 1-ლი წევრისთვის. როგორც წესი, ეს უნდა გაკეთდეს იმ წევრში, რომელსაც აქვს ატომების უდიდესი რაოდენობა, რომლებიც რედოქსს განიცდიან. თუ ეს კრიტერიუმი ვერ შესრულდება, ჩვენ ვაქცევთ მნიშვნელობებს ყველაზე მეტი ქიმიური სახეობის წევრისთვის. აქ გაკეთდა ეს, რადგან მე -2 წევრს მეტი ნივთიერება აქვს.
მე -4 ნაბიჯი: საცდელი დაბალანსება:
კმ.ნ.4 + HCl KCl + 2 MnCl2 + 5 კლ2 + თ2ო
- რადგან მეორე წევრში არის მანგანუმის ორი ატომი, როგორც ეს კოეფიციენტით არის ნაჩვენები, პირველში ასევე უნდა არსებობდეს. ასე რომ, ჩვენ გვაქვს:
2 კმ.ნ.4 + HCl → KCl + 2 MnCl2 + 5 კლ2 + თ2ო
- ამრიგად, კალიუმის (K) რაოდენობა 1 წევრში იყო 2, რაც იგივე კოეფიციენტი იქნება ამ წევრისთვის მეორე წევრისთვის:
2 კმ4 + HCl 2 KCl + 2 MnCl2 + 5 კლ2 + თ2ო
- ქლორის (Cl) რაოდენობა მე -2 წევრში სულ 16-ია, ამიტომ 1-ლი წევრის HCl კოეფიციენტი იქნება:
2 კმ4 + 16 HCl 2 KCl + 2 MnCl2 + 5 კლ2 + თ2ო
- წყალბადის რაოდენობა 1 წევრში არის 16, აქედან მოდის წყლის კოეფიციენტი (H2მე -2 წევრის O) ტოლი იქნება 8, რადგან წყალბადის ინდექსის (2) გამრავლება 8-ზე ტოლია 16:
2 კმ4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 კლ2 + 8 ჰ2ო
- შეამოწმეთ არის თუ არა განტოლება სწორად დაბალანსებული, ჩვენ ვხედავთ ორი კრიტერიუმის:
პირველი) შეამოწმეთ, არის თუ არა თითოეული ატომის რაოდენობა ორ წევრში თანაბარი:
2 კმ4 + 16 HCl →2 KCl + 2 MnCl2 + 5 კლ2 + 8 სთ2ო
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
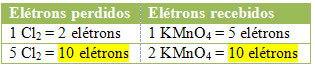
მე -2) ნახეთ, დაკარგული ელექტრონების საერთო რაოდენობა ტოლია თუ არა მიღებული ელექტრონების მთლიანი რაოდენობის:
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm
