არსებობს მეცნიერების ის დარგი, რომელიც შეისწავლის ქიმიური რეაქციების სიჩქარეს და მასზე მოქმედ ფაქტორებს, მას ქიმიური კინეტიკა ეწოდება. ქიმიური რეაქციები შეიძლება განისაზღვროს, როგორც ფენომენების ერთობლიობა, რომელშიც ორი ან მეტი ნივთიერება რეაგირებს ერთმანეთთან, წარმოშობს სხვადასხვა ნაერთებს. ქიმიური განტოლება არის ქიმიური რეაქციის გრაფიკული გამოსახულება, სადაც რეაქტივები ჩნდება პირველ წევრში, ხოლო პროდუქტები მეორეში.
A + B  C + D
C + D
რეაგენტების პროდუქტები
რეაქციების ცოდნა და შესწავლა, გარდა იმისა, რომ ძალიან მნიშვნელოვანია ინდუსტრიული თვალსაზრისით, ასევე დაკავშირებულია ჩვენს ყოველდღიურ ცხოვრებასთან.
რეაქციის სიჩქარე არის ის, თუ რამდენად სწრაფად მოიხმარენ რეაქტორები ან რამდენად სწრაფად წარმოიქმნება პროდუქტები. სანთლის დაწვა და ჟანგის წარმოქმნა ნელი რეაქციების მაგალითებია. დინამიტში ნიტროგლიცერინის დაშლა სწრაფი რეაქციაა.
ქიმიური რეაქციების სიჩქარე განისაზღვრება ემპირიული კანონების საშუალებით, რომელსაც ეწოდება კანონები სიჩქარე, გამომდინარეობს რეაქტორებისა და პროდუქტების კონცენტრაციის ზეგავლენის სიჩქარეზე რეაქცია
ქიმიური რეაქციები ხდება სხვადასხვა სიჩქარით და ეს შეიძლება შეიცვალოს, რადგან გარდა ამისა რეაქტივებისა და პროდუქტების კონცენტრაცია, რეაქციის სიჩქარე ასევე დამოკიდებულია სხვა ფაქტორებზე მოსწონს:
რეაგენტის კონცენტრაცია: რაც უფრო მაღალია რეაქტივების კონცენტრაცია, მით უფრო სწრაფი იქნება რეაქცია. იმისათვის, რომ ორ ან მეტ ნივთიერებას შორის რეაქცია მოხდეს, საჭიროა მოლეკულების შეჯახება, ბმულების გაწყვეტა და ახლების წარმოქმნა. შეჯახებების რაოდენობა დამოკიდებული იქნება A და B კონცენტრაციებზე. იხილეთ სურათი:
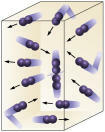
მოლეკულები უფრო ხშირად ეჯახება თუ
ჩვენ ვზრდით რეაქციული მოლეკულების რაოდენობას.
ადვილი მისახვედრია, რომ უფრო მაღალი კონცენტრაციის გამო მოლეკულებს შორის შეჯახება გაიზრდება.
საკონტაქტო ზედაპირი: კონტაქტური ზედაპირის ზრდა ზრდის რეაქციის სიჩქარეს. მაგალითად, როდესაც ჩვენ დაითხოვს დაქუცმაცებული sonrisal ტაბლეტი და იგი უფრო სწრაფად იშლება ვიდრე ეს მთლიანი იქნებოდა, ეს ხდება იმიტომ, რომ ჩვენ ვზრდით კონტაქტურ ზედაპირს, რომელიც რეაგირებს წყალი
წნევა: გაზური სისტემის წნევის გაზრდისას რეაქციის სიჩქარე იზრდება.
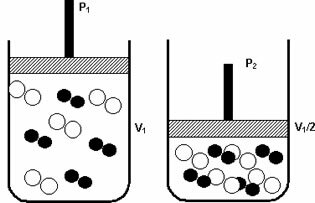
წნევის მატებამ P1- დან P2- მდე შეამცირა მოცულობა V1- დან V1 / 2-მდე, აჩქარებს რეაქციას მოლეკულების მოახლოების გამო.
ზემოთ მოყვანილი ფიგურა გვიჩვენებს, როგორც მეორე კონტეინერში მოცულობის შემცირება, გაიზრდება ზეწოლა აძლიერებს მოლეკულების შეჯახებებს და, შესაბამისად, ზრდის სიჩქარეს რეაქცია
ტემპერატურა: როდესაც სისტემის ტემპერატურა იზრდება, ასევე ხდება რეაქციის სიჩქარის ზრდა. ტემპერატურის გაზრდა ნიშნავს მოლეკულების კინეტიკური ენერგიის გაზრდას. ყოველდღიურად ჩვენ შეგვიძლია დავაკვირდეთ ამ ფაქტორს, როდესაც ვამზადებთ და ვზრდით გაზქურის ალას, რომ საჭმელმა უფრო სწრაფად მიაღწიოს მომზადების ხარისხს.
კატალიზატორები: კატალიზატორი არის ნივთიერებები, რომლებიც აჩქარებენ მექანიზმს მუდმივი შეცვლის გარეშე, ანუ რეაქციის დროს ისინი არ იხმარება. კატალიზატორი საშუალებას აძლევს რეაქციას მიიღოს ალტერნატიული გზა, რაც მოითხოვს ნაკლები აქტივაციის ენერგიას, რის შედეგადაც რეაქცია უფრო სწრაფად მიმდინარეობს. მნიშვნელოვანია გვახსოვდეს, რომ კატალიზატორი აჩქარებს რეაქციას, მაგრამ არ ზრდის მოსავლიანობას, ანუ იგი აწარმოებს იმავე რაოდენობის პროდუქტს, მაგრამ უფრო მოკლე დროში.
ლირია ალვესის მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm