ატომი არის სახელი, რომელსაც მიენიჭა მატერიის შემქმნელი (ყველაფერი, რაც იკავებს ადგილს და აქვს მასა). ეს სახელი შემოთავაზებულია ბერძენი ფილოსოფოსების დემოკრიტესა და ლევკიპუსის მიერ. ქიმიური ელემენტები, მოლეკულები, ნივთიერებები ხოლო ორგანულ ან არაორგანულ მასალებს ატომები ქმნიან.
თავის კონსტიტუციაში ატომს აქვს ნაწილაკები (პროტონები, ნეიტრონები და ელექტრონები), რაც არ არის მატერიის მცირე ნაწილი. Ისევ, თქვენი ვიზუალიზაცია შეუძლებელია. რაც ცნობილია ატომის შესახებ, დაკავშირებულია მეცნიერულად დადასტურებულ ფიზიკურ, ქიმიურ და მათემატიკურ ასპექტებთან.
ატომის შესახებ ცოდნის ევოლუციამ განაპირობა რამდენიმე ტექნოლოგიის შემუშავება და გაუმჯობესება.
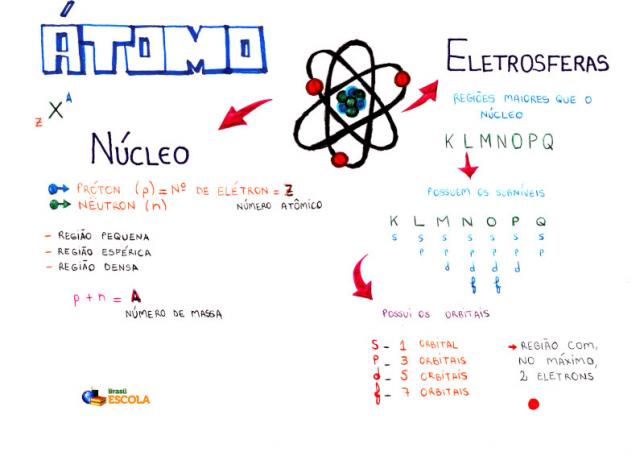
ატომის ძირითადი შემადგენლობა
ძირითადი: ატომის უფრო მკვრივი რეგიონი და ფლობს პროტონებსა და ნეიტრონებს;
ენერგიის დონეები: რეგიონები, რომლებიც გარს აკრავს ბირთვს, და სადაც განთავსებულია ქვედონეები, ორბიტალები და ელექტრონები. არსებობს შვიდი ენერგიის დონე, რომლებიც წარმოდგენილია ასოებით K, L, M, N, O, P და Q;
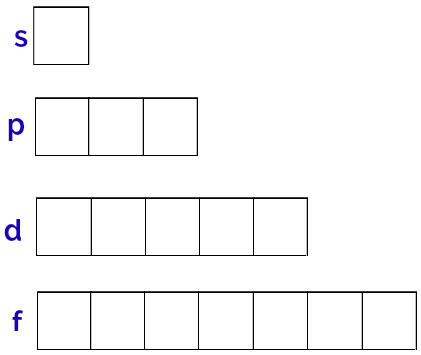
ენერგეტიკული ქვეჯგუფები: არის რეგიონები, სადაც მდებარეობს ორბიტალები. ისინი წარმოდგენილია ყველა დონეზე და წარმოდგენილია ასოებით (s, p, d f). მისი რაოდენობა თითოეულ დონეზეა დამოკიდებული: K (აქვს ქვესასოფლელები), L (აქვს s და p ქვედონეები), M (აქვს s, p და d ქვედენტიანი), N (აქვს ქვესკეტები s, p, d და f), O (აქვს ქვესასტუმრები s, p, d და f), P (აქვს ქვესასტუმრები s, p და d) და Q (აქვს ქვესასტუმრები s და P);
ატომური ორბიტალები: რეგიონები, რომლებიც, სავარაუდოდ, იპოვიან ელექტრონს. თითოეულ ქვექვემდებარებას აქვს ორბიტალების სხვადასხვა რაოდენობა: s (ერთი ორბიტალი), p (სამი ორბიტალი), d (ხუთი ორბიტალი) და f (შვიდი ორბიტალი);
პროტონები: დადებითი ნაწილაკები (წარმოდგენილია p- ით);
ელექტრონები: უარყოფითი ნაწილაკები, რომლებსაც აქვთ ტალღის ქცევა (წარმოდგენილია ე-ით);
ნეიტრონები: დატვირთული ნაწილაკები, რომლებიც ამცირებენ ბირთვში პროტონებს შორის მოგერიებას (წარმოდგენილია n- ით).
გონების რუქა: ატომი
* გონებრივი რუქის PDF გადმოსაწერად, Დააკლიკე აქ!
ატომის წარმოდგენა
ატომის წარმოდგენის უმარტივესი გზაა მის მიერ წარმოქმნილი ქიმიური ელემენტის აბრევიატურა. მაგალითად, აბრევიატური Se წარმოადგენს ყველა ატომს, რომლებიც ქმნიან სელენის ქიმიურ ელემენტს.
აბრევიატურას, რომელიც წარმოადგენს ატომს, კვლავ შეუძლია ორი მნიშვნელოვანი ინფორმაციის მოწოდება: ატომური ნომერი (წარმოდგენილია ასო Z- ით და ყოველთვის მარცხენა მხარეს ატომის აბრევიატურა) და მასის რიცხვი (წარმოდგენილია ასო A- ით, რომელიც შეიძლება განლაგდეს მარცხენა ან მარჯვენა მხარეს აკრონიმის ზედა ნაწილში) ატომი).
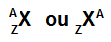
ატომის აკრონიმი მასის ნომრით და ატომური რიცხვით
ატომური ნომერი (Z): მიუთითებს ატომის ბირთვში არსებული პროტონების რაოდენობაზე და ენერგიის დონეებში არსებული ელექტრონების (ე) რაოდენობაზე.
ფორმულა, რომელიც მიუთითებს ატომური რიცხვის წარმომადგენლობითობაზე
-
მასის ნომერი (A): მიუთითებს ატომის ბირთვში არსებულ მასაზე, რომელიც გამომდინარეობს პროტონის (p) და ნეიტრონების რაოდენობის (n) ჯამიდან.
ნუ გაჩერდები ახლა... რეკლამის შემდეგ მეტია;)

ფორმულა, რომელიც მიუთითებს მასობრივი რიცხვის წარმომადგენლობითობაზე
ატომური მსგავსება
ერთი და იგივე ქიმიური ელემენტის ან სხვადასხვა ქიმიური ელემენტის ატომები შეიძლება შედარდეს პროტონების, ელექტრონების, ნეიტრონების და მასის მიხედვით, და კლასიფიცირებულია შემდეგნაირად:
ა) იზოტოპები
ისინი ატომები არიან, რომლებსაც აქვთ:
იგივე ატომური ნომერი;
პროტონის იგივე რაოდენობა;
სხვადასხვა მასის ნომერი;
ნეიტრონების სხვადასხვა რაოდენობა;
მაგალითი:
A და B ატომები იზოტოპები არიან
A და B ატომები იზოტოპები არიან, რადგან:
ატომს A აქვს 15 პროტონი, ატომური რიცხვი ტოლია 15, 15 ელექტრონი, 15 ნეიტრონი და მასის რიცხვი 30 ტოლია.
ატომ B- ს აქვს 15 პროტონი, ატომური რიცხვი უდრის 15, 15 ელექტრონს, 20 ნეიტრონს და მასის რიცხვს უდრის 35-ს.
ბ) იზობარები
ისინი ატომები არიან, რომლებსაც აქვთ:
სხვადასხვა ატომური რიცხვები;
პროტონის სხვადასხვა რაოდენობა;
ელექტრონების სხვადასხვა რაოდენობა;
იგივე მასის რიცხვები;
ნეიტრონების სხვადასხვა რაოდენობა.
მაგალითი:
C და D ატომები იზობარებია
C და D ატომები იზობარულია, რადგან:
C ატომს აქვს 32 პროტონი, ატომური რიცხვი უდრის 32, 32 ელექტრონს, 23 ნეიტრონს და მასის რიცხვი 55-ს ტოლია.
D ატომს აქვს 37 პროტონი, ატომური რიცხვი უდრის 37, 37 ელექტრონს, 18 ნეიტრონს და მასის რიცხვი 55-ს ტოლია.
გ) იზოტონები
ისინი ატომები არიან, რომლებსაც აქვთ:
სხვადასხვა ატომური რიცხვები;
პროტონის სხვადასხვა რაოდენობა;
ელექტრონების სხვადასხვა რაოდენობა;
სხვადასხვა მასის რიცხვები;
ნეიტრონების იგივე რაოდენობა.
მაგალითი:
E და F ატომები იზოტოპები არიან
E და F ატომები იზოტოპები არიან, რადგან:
ატომ E- ს აქვს 20 პროტონი, ატომური რიცხვი ტოლია 20, 20 ელექტრონი, 20 ნეიტრონი და მასის რიცხვი ტოლია 40.
F ატომს აქვს 30 პროტონი, ატომური რიცხვი უდრის 30, 30 ელექტრონს, 20 ნეიტრონს და მასის რიცხვს უდრის 50-ს.
დ) იზოელექტრონიკა
ისინი ატომები არიან, რომლებსაც აქვთ:
ელექტრონების იგივე რაოდენობა.
ᲨᲔᲜᲘᲨᲕᲜᲐ: იზოელექტრონულ ატომებს შეიძლება ჰქონდეთ იგივე მასის რიცხვი (იზობარები), იგივე რაოდენობის ნეიტრონები (იზოტონები) ან იგივე პროტონების (იზოტოპები).
მაგალითი:
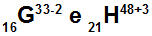
G და H ატომები არის იზოელექტრონული
G და H ატომები არის იზოელექტრონული, რადგან:
ატომ G- ს აქვს 16 პროტონი, ატომური რიცხვი უდრის 16, 18 ელექტრონს (ნიშანი -2 მიუთითებს იმაზე, რომ მას აქვს კიდევ ორი ელექტრონი ვიდრე პროტონის რაოდენობა), 17 ნეიტრონი და მასის რიცხვი 33-ის ტოლია.
ატომ H- ს აქვს 21 პროტონი, ატომური რიცხვი უდრის 21, 18 ელექტრონს (+3 ნიშანი მიანიშნებს, რომ მას აქვს სამი ნაკლები ელექტრონი, ვიდრე პროტონის რაოდენობა), 27 ნეიტრონი და მასის რიცხვი 48-ის ტოლია.
ჩემ მიერ. დიოგო ლოპეს დიასი
გსურთ მიუთითოთ ეს ტექსტი სასკოლო ან აკადემიურ ნაშრომში? შეხედე:
DAYS, დიოგო ლოპესი. "რა არის ატომი?"; ბრაზილიის სკოლა. Ხელმისაწვდომია: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm. წვდომა 2021 წლის 27 ივნისს.
Ქიმია
ატომები და სამყაროს აგება, ატომური თეორია, რომ ყველაფერი შექმნილია, მატერია შედგება ატომებისაგან, ოთხი ელემენტის თეორია, ძველი ალქიმიკოსები, ატომური თეორია, ფუნდამენტური ნაწილაკი.
Ქიმია

ნილს ბორი, ბორის ატომი, ატომური ფიზიკა, სტაბილური ატომი, ატომური მოდელი, პლანეტარული სისტემა, ელექტროსფეროს ფენები, ენერგიის დონეები, ელექტრონული გარსი, ელექტრონული ენერგია, რეზერფორდის ატომური მოდელი, აღგზნებული მდგომარეობის ატომი.