ვინაიდან არსებობს ოქტეტის წესის გამონაკლისები, საიდან ვიცით ატომებს შორის სწორი განლაგება მოლეკულის წარმოქმნისას?
ეს შეიძლება გაკეთდეს თითოეული სტრუქტურის ფორმალური დატვირთვის გაანგარიშებით. ფორმალური მუხტი, რომელიც ყველაზე ახლოს არის ნულთან, იქნება რეალური არსებობის უდიდესი ალბათობით. გაითვალისწინეთ, რომ ეს არის "ყველაზე ახლოს ნულთან", ამიტომ არ არის საჭირო ნულის ტოლი.
ოფიციალური მუხტის ფორმულა (Cfo) é:
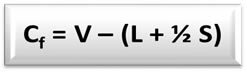
V = თავისუფალი ატომის ვალენტური ელექტრონების რაოდენობა;
L = ელექტრონის რაოდენობა, რომელიც სტრუქტურაშია ატომის იზოლირებულ (არაკავშირულ) წყვილებში;
S = ატომის მიერ ელექტრონულ ელექტრონთა რაოდენობა, რომელიც აგებულია სტრუქტურაში.
იმის გასაგებად, თუ როგორ ხდება ეს, წარმოიდგინეთ, რომ გვინდა ვიცოდეთ რა არის Lewis ელექტრონული სტრუქტურა SO მოლეკულისთვის.2. ჩვენ გვაქვს ორი შესაძლო შეთანხმება ატომებს შორის:
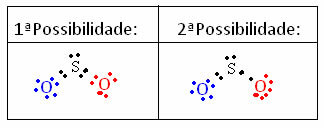
გამოითვლება სტრუქტურებში მონაწილე ყველა ატომის ფორმალური მუხტი. შეხედე:
პირველი შესაძლებლობა:
გოგირდი (S): ჟანგბადი (O) ჟანგბადი (O)
ჩf (S) = 6 – (2 + ½ 8) ჩf (S) = 6 – (4 + ½ 4) ჩf (S) = 6 – (4 + ½ 4)
ჩf (S) =0 ჩf (S) =0 ჩf (S) =0
მე -2 შესაძლებლობა:
გოგირდი (S): ჟანგბადი (O) ჟანგბადი (O)
ჩf (S) = 6 – (2 + ½ 6) ჩf (S) = 6 – (6 + ½ 2) ჩf (S) = 6 – (4 + ½ 4)
ჩf (S) = +1ჩf (S) = -1 ჩf (S) =0
მიღებული შედეგების საფუძველზე შეგვიძლია აღვნიშნოთ, რომ პირველი სტრუქტურა არის რეალური არსებობის ყველაზე მაღალი ალბათობის. ჩვენ ვიცით, რომ ის არ ასრულებს ოქტეტის წესს, მაგრამ გოგირდისმა გააფართოვა ვალენტური გარსი და 10 ელექტრონით დარჩა სტაბილური.
ეს წესი ასევე მოქმედებს იონების სწორი წყობის პოვნაზე.
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/calculo-carga-formal.htm


