ბევრ მედიკამენტში, თხევად და მყარ საკვებ პროდუქტებში, როგორიცაა ძმარი და ორცხობილა, მაგალითად, შინაარსი გახსნილი ნივთიერების პროცენტულ მასაში (m1) მთლიანი ხსნარის მასასთან მიმართებაში (m = m.)1 + მ2). ამ სიდიდეს ეწოდება სათაური (T) ან მასის პროცენტი გამოსავალი.
მისი განმარტება შეიძლება შემდეგნაირად გამოითქვას:

ამრიგად, მისი გაანგარიშება ხდება ქვემოთ მოცემული მათემატიკური განტოლების საშუალებით:
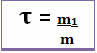
ან

რადგან მნიშვნელიც და მრიცხველიც ერთ ერთეულთან გვაქვს საქმე (მასობრივი ერთეული გრამია - g), სათაურს არა აქვს ერთეული და 1-ზე ნაკლებია.
ამრიგად, თუ ვიტყვით, რომ მოცემული ხსნარის სათაურია 0.4, ეს ნიშნავს, რომ ხსნარის მასის თითოეული ერთეულისთვის 0.4 შეესაბამება ხსნადი მასის. ამასთან, სათაური ხშირად გამოხატულია პროცენტულად. ამისათვის უბრალოდ გაამრავლეთ ნაპოვნი მნიშვნელობა 100% -ზე. ამ შემთხვევაში მას უწოდებენ მასობრივი პროცენტი (თ%) *
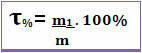
გაითვალისწინეთ ქვემოთ მოცემული ფიგურა, რომელშიც მოცემულია მარილის ხსნარში ნატრიუმის ქლორიდის მასის პროცენტული მაჩვენებელი:

ფიზიოლოგიური ხსნარი, რომელიც გამოიყენება დეჰიდრატაციის სამკურნალოდ, შეიცავს ნატრიუმის ქლორიდის მასობრივ პროცენტს 0,9%
ამ შემთხვევაში, ეს ნიშნავს, რომ ამ ხსნარის ყოველ 100 გრ ან 100 ერთეულში არის 0,9 გ ან 0,9% ხსნადი, ანუ ნატრიუმის ქლორიდი (NaCl - სუფრის მარილი).
კიდევ ერთი მაგალითია ძმარი: მის ეტიკეტზე მითითებულია, რომ მის მომზადებაში გამოყენებულია ძმარმჟავას მასის 5%, ანუ ამ მჟავას აქვს 5 გრ ყოველ 100 გრ ხსნარში.

სათაური ასევე მოცემულია აქ მოცულობის პროცენტი. ამ შემთხვევაში განსხვავება მხოლოდ იმაშია, რომ ხსნადი მასის ხსნარის მასასთან ურთიერთდაკავშირების ნაცვლად; ხსნადის მოცულობა უკავშირდება ხსნარის მოცულობას შემდეგი ფორმულის შესაბამისად:
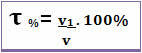
მაგალითად, ჩვეულებრივი ალკოჰოლის შემთხვევაში, რომელსაც აქვს პროცენტული მოცულობა 96%, 100 მლ ხსნარში, 96 მლ არის ალკოჰოლი.

* ტერმინი "სათაური" უფრო მეტად გამოიყენება მეცნიერებში, ხოლო ტექნიკოსები და რამდენიმე წიგნის ავტორი უფრო ხშირად იყენებენ გამოთქმას "მასის პროცენტი".
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm