ო ატომური რადიუსი (r) ჩვეულებრივ განისაზღვრება, როგორც მეზობელი ატომების ორ ბირთვს შორის მანძილის ნახევარიროგორც ქვემოთ მოცემული ფიგურაა:

ატომური რადიუსი
ატომური რადიუსი განსხვავდება ერთი ატომიდან მეორეზე ოჯახის და პერიოდული ცხრილის მიხედვით. იმ ელემენტების მიმართ, რომლებიც მიეკუთვნება ა იგივე ოჯახი, მისი ატომური რადიუსი იზრდება ატომური რიცხვის ზრდით., ანუ ზემოდან ქვევით. ამ გაგებით, ეს ნიშნავს, რომ ერთი ატომიდან მეორეზე ენერგიის დონე ან ელექტრონული ფენა გაიზარდა, ამიტომ მისი რადიუსი პროპორციულად იზრდება.
ელემენტთან დაკავშირებით იმავე პერიოდშიჰორიზონტალურად, რადიუსი იზრდება მარჯვნივ მარცხნიდან, ან ატომური რაოდენობის შემცირებისთანავე. ეს იმიტომ ხდება, რომ ყველას აქვს ერთი და იგივე რაოდენობის ფენები, რაც განსხვავებას ქმნის არის თანხის ოდენობა ელექტრონები ამ ფენებში და რაც მეტი ელექტრონია, მით უფრო დიდია ბირთვის მიზიდულობა, რაც ამცირებს რადიუსის რადიუსს ატომი.

ატომური რადიუსის ზრდის მიმართულება პერიოდულ ცხრილში ოჯახის და პერიოდის მიხედვით
ამასთან, ატომური რადიუსი შეიძლება შეიცვალოს, რაც დამოკიდებულია კავშირზე. ვნახოთ როგორ ხდება ეს:
* იონური ბონდი: თუ ატომი ა კათიონი, ატომური რადიუსი შემცირდება, ერთი ან მეტი ელექტრონის დაკარგვის შემდეგ, ბირთვი უფრო ინტენსიურად მიიზიდავს ელექტრონებს. ახლა თუ შექმნან ანიონი, ანუ მიიღებენ ელექტრონებს, ატომის რადიუსი გაიზრდება, რადგან ელექტროსფეროს საერთო მუხტი უფრო მეტი იქნება, ვიდრე ბირთვის საერთო მუხტი, რაც ამცირებს მის მოზიდვას. რაც უფრო მეტ ელექტრონს მიიღებთ ან კარგავთ, მით მეტი იქნება სხივის ზომის ცვალებადობა.
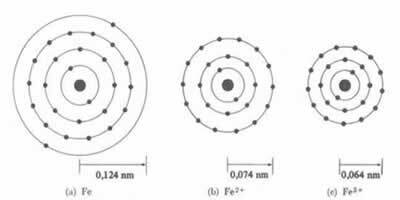
კათიონის დიამეტრი ან რადიუსი ყოველთვის მცირეა ვიდრე ატომის დიამეტრი ან რადიუსი
ასევე, სერია იზოელექტრონული იონები, რომელთაც აქვთ იგივე რაოდენობის ელექტრონები და ენერგიის დონე, ყველაზე მცირე ატომური რიცხვის მქონე იონს უფრო დიდი რადიუსი ექნება. მაგალითად, იონები 13ალ3+, 12მგ2+, 11საათზე1+, 9ვ-1, 8ო2- და 7ნ-3, ყველას აქვს 10 ელექტრონი და 2 ელექტრონული დონე. მაგრამ ყველაზე დიდი რადიუსი არის ის 7ნ-3, რადგან მას აქვს ყველაზე მცირე ატომური რიცხვი (Z = 7).
*Კოვალენტური ბმა: როდესაც ორი ატომი ქმნის კოვალენტურ კავშირს, თუ ორი ატომი ტოლიაწყალბადის გაზის შემთხვევაში (ჰ2), შეიძლება ვისაუბროთ კოვალენტურ რადიუსზე (r), რომელიც არის ბმის (d) სიგრძის ნახევარი, ანუ ორი ბირთვის გამყოფი მანძილიდან ნახევარი. თუმცა, თუ ბმას ქმნიან სხვადასხვა ატომები, როგორც წყალბადის ქლორიდის (HCl) შემთხვევაში, სიგრძე ან მანძილი (დ) იქნება კოვალენტურობაში ჩართული ატომების კოვალენტური რადიუსის (r1 + r2) ჯამი.
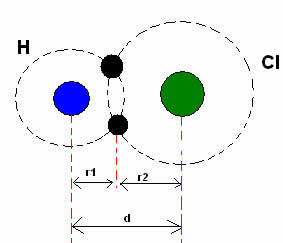
ატომური სხივების ჯამი კოვალენტურ კავშირში.
რა თქმა უნდა, უნდა გვახსოვდეს, რომ ეს საკითხი გაცილებით რთულია, რადგან ატომის კოვალენტური რადიუსი შეიძლება განსხვავდებოდეს, რადგან ის სხვა სხვადასხვა ატომებთან კავშირშია.
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm
