THE ბატარეა არის სისტემა, სადაც მიმდინარეობს ჟანგვა-აღდგენითი რეაქცია. ამ მოწყობილობაში სპონტანური რეაქციის შედეგად წარმოქმნილი ქიმიური ენერგია გარდაიქმნება ელექტრო ენერგიად.
ჟანგვის და შემცირების რეაქციები ხდება უჯრედში ერთდროულად. როდესაც ერთი სახეობა განიცდის დაჟანგვას, ის აძლევს ელექტრონებს მეორე სახეობას, რომლებიც მათი მიღებისთანავე განიცდის შემცირებას.
მაშასადამე, ის, ვინც განიცდის ჟანგვას, არის აღმდგენი აგენტი, ხოლო ის, ვინც განიცდის შემცირებას, არის ჟანგვის აგენტი.
THE დაჟანგვა ხდება მაშინ, როდესაც სახეობა კარგავს ელექტრონებს და ხდება კატიონი: A → A+ + და-.
THE შემცირება ხდება მაშინ, როდესაც სახეობა იძენს ელექტრონებს და ხდება ელექტრონულად ნეიტრალური: B+ + და- → ბ.
ქიმიურ განტოლებებში ეს ელექტრონის გადაცემა ნაჩვენებია ჟანგვის რიცხვის (nox) ცვლილებით.
შემცირების რეაქციები ხდება უჯრედების შიგნით და ელექტრული დენი წარმოიქმნება ელექტრონების მიგრაციით უარყოფითი პოლუსიდან დადებით პოლუსზე.

როგორ მუშაობს სტეკი?
ერთი რედოქსის რეაქცია ზოგადად შეიძლება წარმოდგენილი იყოს განტოლებით:
A + B+ → ა+ + B
სად,
პასუხი: ნივთიერება, რომელიც იჟანგება, კარგავს ელექტრონებს, ზრდის მის მნიშვნელობას და არის შემცირების საშუალება.
B: ნივთიერება, რომელიც განიცდის რედუქციას, იძენს ელექტრონებს, ამცირებს დაჟანგვას და წარმოადგენს ჟანგვის აგენტს.
იხილეთ შემდეგ სურათზე, თუ როგორ შეიძლება ეს პროცესი იყოს წარმოდგენილი.
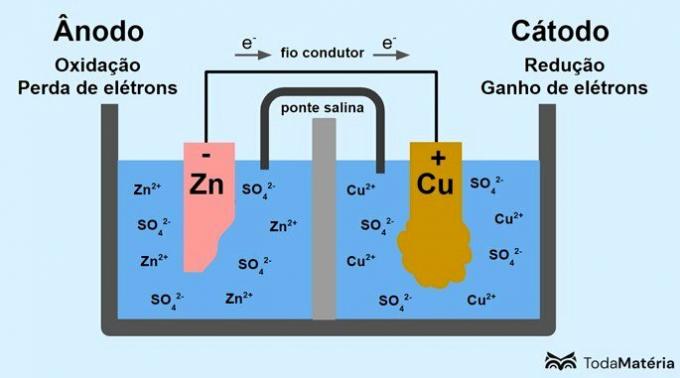
სისტემა გაყოფილი ორ ნახევარუჯრედად და ჩამოყალიბებული ორი მეტალის ელექტროდის მიერ, რომლებიც გარედან დაკავშირებულია გამტარ მავთულით, შეიმუშავა ჯონ ფრედერიკ დანიელმა (1790-1845) 1836 წელს.
ბატარეა შედგება ორი ელექტროდისგან, რომლებიც დაკავშირებულია გამტარ მავთულით და ელექტროლიტისაგან, სადაც იონებია. ელექტროდი არის მყარი გამტარი ზედაპირი, რომელიც საშუალებას აძლევს ელექტრონების გაცვლას.
ანოდი: ელექტროდი, რომელზეც ხდება დაჟანგვა. ეს ასევე არის ბატარეის უარყოფითი პოლუსი.
კათოდი: ელექტროდი, რომელზეც ხდება შემცირება. ეს ასევე არის ბატარეის დადებითი პოლუსი.
ზემოთ მოცემულ სურათზე მეტალის თუთია არის ანოდი და გადის დაჟანგვა. მეტალის სპილენძი არის კათოდი და განიცდის შემცირებას. ელექტრონების მიგრაცია (e-) ხდება ანოდიდან კათოდში გამტარ მავთულის მეშვეობით.
გამოსახულებების სისტემაში წარმოქმნილი რეაქციებია:
- ანოდი (დაჟანგვა): Zn(s) → Zn2(აქ) + 2e-
- კათოდი (შემცირება): Cu2+(აქ) + 2e- → ტრაკი(s)
- ზოგადი განტოლება: Zn(s) + ტრაკი2+(აქ) → ტრაკი(s) + Zn2+(აქ)
თუთია არის ლითონი, რომელსაც აქვს ელექტრონების დაკარგვის მეტი ტენდენცია და, შესაბამისად, ხსნარში წარმოიქმნება კათიონები. თუთიის ელექტროდი იწყებს ცვეთას და კარგავს მასას, რადგან თუთია გამოიყოფა ხსნარში Zn კათიონების ფორმირებისას2+.
ანოდიდან ელექტრონები ჩადიან კათოდში და ლითონის კათიონები მათი მიღებისთანავე გარდაიქმნება მეტალის სპილენძად, რომელიც დეპონირდება ელექტროდზე და ზრდის მის მასას.
მარილის ხიდი არის იონური დენი, რომელიც პასუხისმგებელია სისტემაში იონების ცირკულაციაზე, რათა ის ელექტრონულად ნეიტრალური იყოს.
ასევე წაიკითხეთ შესახებ ჟანგვის ნომერი (nox).
ბატარეის ტიპები
უჯრედში ქიმიური სახეობების მიდრეკილება ელექტრონების მიღების ან დონაციის მიმართ განისაზღვრება შემცირების პოტენციალით.
ყველაზე მაღალი შემცირების პოტენციალის მქონე კომპონენტი განიცდის შემცირებას, ანუ ელექტრონების მოპოვებას. ყველაზე დაბალი შემცირების პოტენციალის მქონე სახეობები და, შესაბამისად, უმაღლესი დაჟანგვის პოტენციალი, მიდრეკილია ელექტრონების გადაცემისკენ.
მაგალითად, რედოქს რეაქციაში Zn0(s) + ტრაკი2+(აქ) → ტრაკი0(s) + Zn2+(აქ)
თუთია იჟანგება და აძლევს ელექტრონებს, რადგან მას აქვს შემცირების პოტენციალი E0 = -0,76 ვ, ნაკლები სპილენძის E-ის შემცირების პოტენციალზე0 = +0,34V და, შესაბამისად, იღებს ელექტრონებს და განიცდის რედუქციას.
იხილეთ ქვემოთ დასტაების სხვა მაგალითები.
თუთია და წყალბადის დასტა
ჟანგვის ნახევარრეაქცია: Zn(s) → Zn2+ + 2e- (და0 = -0,76 ვ)
შემცირების ნახევარრეაქცია: 2სთ+(აქ) + 2e- → ჰ2 (გ) (და0 =0.00 ვ)
გლობალური განტოლება: Zn(s) + 2 სთ+(აქ) → Zn2+(აქ) + H2 (გ)
სტეკის წარმოდგენა:
სპილენძის და წყალბადის უჯრედი
ჟანგვის ნახევარრეაქცია: H2 (გ) → 2 სთ+(აქ) + 2e- (და0 = 0.00 ვ)
შემცირების ნახევარრეაქცია: Cu2+(აქ) + 2e- → ტრაკი(s) (და0 = +0,34 ვ)
გლობალური განტოლება: Cu2+(აქ) + H2 (გ) → 2 სთ+(აქ) + ტრაკი(s)
სტეკის წარმოდგენა:
მიიღეთ მეტი ცოდნა თემის შესახებ შინაარსით:
- ელექტროქიმია
- ელექტროლიზი
ბიბლიოგრაფიული ცნობები
ფონსეკა, მ. რ. მ. ქიმია, 2. 1. რედ. სან პაულო: ატიკა, 2013 წ.
SANTOS, W.L.P; MOL, გ.ს. მოქალაქე ქიმია, 3. 2. რედ. სან პაულო: Editora AJS, 2013 წ.
USBERCO, ჯ. დააკავშირე ქიმია, 2: ქიმია. - 2. რედ. სან პაულო: სარაივა, 2014 წ.


