THE ქრომი, ატომური ნომერი 24, არის გარდამავალი ლითონი, რომელიც მდებარეობს პერიოდული ცხრილის მე-6 ჯგუფში. მისი ფერი ნაცრისფერია, მაგრამ ასევე ძალიან პრიალა ლითონია. ის ძირითადად არსებობს +2, +3 და +6 დაჟანგვის მდგომარეობებში და აქვს ის თვისება, რომ მისი ყველა ნაერთი შეფერილია. გასაკვირი არ არის, რომ მისი სახელი მომდინარეობს ბერძნულიდან ქრომა, რაც ნიშნავს ფერს.
ეს ელემენტი მიიღება ქრომიტის მეშვეობით და ფართოდ გამოიყენება მეტალურგიულ მრეწველობაში, უჟანგავი ფოლადის და სხვა სპეციალური შენადნობების წარმოებაში. ქრომის მოოქროვება ასევე შესაძლებელია ობიექტებზე, ეფექტით, რომელიც ცნობილია როგორც ქრომირებული მოოქროვილი, რაც, გარდა სილამაზისა, უზრუნველყოფს დიდ ქიმიურ წინააღმდეგობას. ქრომის ნაერთები ასევე გამოიყენება პიგმენტებსა და საღებავებში, გარდა ცეცხლგამძლე მასალებისა.
წაიკითხეთ ასევე: ჰაფნიუმი - გარდამავალი ლითონი, რომელსაც აქვს ცირკონიუმის მსგავსი თვისებები
ქრომის შეჯამება
ქრომი არის ნაცრისფერი, მბზინავი ლითონი, რომელიც ხსნის მე-6 ჯგუფს Პერიოდული ცხრილი.
ძალიან მდგრადია კოროზიისა და ქიმიური შეტევის მიმართ ოთახის ტემპერატურაზე.
იგი ძირითადად ავლენს ჟანგვის მდგომარეობებს +2, +3 და +6.
მის ყველა ნაერთს აქვს ფერი.
მისი მიღება შესაძლებელია ქრომიტისგან, FeCr2THE4.
მას ძირითადად მეტალურგიული მრეწველობა იყენებს, რომელიც მას წარმოებაში იყენებს უჟანგავი ფოლადი.
ის 1797 წელს აღმოაჩინა ფრანგმა ლუი ნიკოლა ვოკლენმა.
[pullicity_omnia]
ქრომის თვისებები
სიმბოლო: ქრ.
ატომური ნომერი: 24.
ატომური მასა: 51.9961 ქ.ს.
ელექტროუარყოფითობა: 1,66.
შერწყმის წერტილი: 1907°C.
Დუღილის წერტილი: 2671°C.
სიმკვრივე: 7,15 გ.სმ-3 (20°C-ზე).
ელექტრონული კონფიგურაცია: [ჰაერი] 4წ1 3D5.
ქიმიური სერია: ჯგუფი 6, მეს არის გარდამავალი.
ქრომის მახასიათებლები
ქრომი, ატომური ნომერი 24, არის a ლითონის ნაცრისფერი, მყარი და პრიალა. ოთახის ტემპერატურაზე ის კარგად უძლებს ქიმიურ შეტევებს, როგორიცაა მჟავე ან ძირითადი ხსნარებიდან, გარდა HCl და H.2მხოლოდ4 განზავებული. თუმცა, მაღალ ტემპერატურაზე, ქრომი ბევრად უფრო რეაქტიული ხდება და ადვილად იჟანგება O-ით2, და აერთიანებს ჰალოგენებს და უმეტეს არამეტალებს.
ხსნარში, ქრომის ნაერთებს აქვთ დაჟანგვის რიცხვები +6, +3 და +2. სინამდვილეში, საინტერესო თვისება ის არის ყველა ქრომის ნაერთები ფერადია, როგორიცაა დიქრომატის კალიუმი, კ2ქრ2THE7, რომელიც არის ნარინჯისფერი და კალიუმის ქრომატი, კ2CrO4, რომელიც ყვითელია.
ცნობისმოყვარე ფაქტი ქრომის შესახებ არის ის მისი ელექტრონული კონფიგურაცია არ შეესაბამება მოსალოდნელ ნიმუშს. მიღების თქვენი ელექტრონული განაწილება, მოსალოდნელია იყოს [Ar] 4s2 3D4თუმცა, ენერგიისა და სტაბილურობის გამოთვლები აჩვენებს, რომ [Ar] 4s კონფიგურაცია1 3D5 ის უფრო სტაბილურია. ეს შეიძლება აიხსნას იმით ჰუნდის წესი.
ამ წესის მიხედვით, რაც უფრო მეტია რაოდენობა ელექტრონები თანაბარი (ან პარალელური) სპინებით არასრულ ორბიტალში, მით უფრო დაბალია მისი ენერგია ატომიანუ რაც უფრო დიდია სტაბილურობა. შეხედეთ სურათს ქვემოთ:
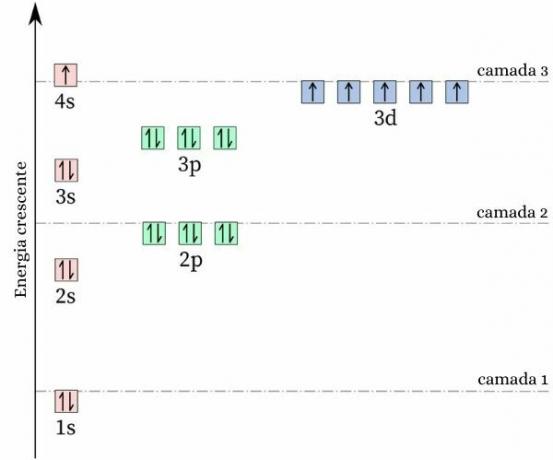
თუ Chrome-მა მიიღო 4s კონფიგურაცია2 3D4, 4s ორბიტალი წარმოადგენდა ელექტრონებს საპირისპირო სპინით (↑↓), რაც გაზრდის მოგერიებას, ბოლოს და ბოლოს, იქნება ერთი და იგივე ნიშნის ორი მუხტი, რომლებიც იზიარებენ ერთ ორბიტალს.
4s კონფიგურაციის მიღებით1 3D5, ქრომი ინახავს ელექტრონების მეტ რაოდენობას თანაბარი სპინით, ელექტრონების არსებობის გარეშე, რომლებიც იზიარებენ ერთსა და იმავე ორბიტალს (როგორც ნაჩვენებია წინა სურათზე), რაც ამცირებს მის ენერგიას და უზრუნველყოფს მეტ სტაბილურობას.
იხილეთ ასევე: ვანადიუმი - ქიმიური ელემენტი, რომლის ხსნარებს ასევე განსხვავებული ფერები აქვთ
სად შეიძლება ქრომის პოვნა?
ქრომი არის მეათე ყველაზე უხვი ელემენტი დედამიწაზე. მიუხედავად იმისა, რომ არსებობს რამდენიმე მინერალი, რომელსაც აქვს ქრომი მათ შემადგენლობაში, ქრომიტი, FeCr2THE4, არის ქრომის ყველაზე მნიშვნელოვანი მინერალი, რომელიც ყველაზე ფართოდ გამოიყენება კომერციულად.

მნიშვნელოვანია აღინიშნოს, რომ ქრომის ყველაზე მაღალი მარაგის მქონე ქვეყნები არიან:
სამხრეთ აფრიკა;
ყაზახეთი;
ინდოეთი;
თურქეთი.
THE ბრაზილია არის ქრომის ერთადერთი მწარმოებელი მთელ ამერიკულ კონტინენტზე, მაგრამ ფლობს მსოფლიო რეზერვების მხოლოდ 0,11%-ს. რეზერვები ძირითადად განაწილებულია შემდეგ შტატებში:
ბაია;
ამაპა;
მინას გერაისი.
ქრომის მიღება

THE იწარმოება მეტალის ქრომი მეშვეობით ქრომიტისგან. ამ შემთხვევაში, მინერალი დნება ნატრიუმის კარბონატი, ზე2CO3ჰაერის თანდასწრებით, წარმოქმნის ნატრიუმის ქრომატს და რკინის III ოქსიდს:
4 FeCr2THE4 + 8 ინჩი2CO3 + 7 ო2 → 8 ინ2CrO4 + 2 Fe2THE3 + 8 CO2
იქიდან მოპოვება ხორციელდება წყალი, ვინაიდან ნა2CrO4 წყალში ხსნადია, ხოლო Fe2THE3 არა. შემდეგ, გარემო მჟავდება H-ით2მხოლოდ4, რომელიც იძლევა ქრომატის კრისტალიზაციის საშუალებას ნატრიუმის. ნა2CrO4 გამოყენებისას მცირდება ქრომის III ოქსიდამდე ნახშირბადის მაღალ ტემპერატურაზე:
ზე2CrO4 + 2 C → Cr2THE3 + ჩართულია2CO3 + CO
ლითონის ქრომი მიიღება მაშინ, როდესაც ალუმინი გამოიყენება როგორც შემამცირებელი აგენტი, ასევე მაღალ ტემპერატურაზე:
ქრ2THE3 + 2 ალ → ალ2THE3 + 2 კრ
ქრომის აპლიკაციები
THE ინდუსტრია მეტალურგიული არის ქრომის მთავარი მომხმარებელი, წარმოებული ქრომის დაახლოებით 80%, ქრომიტის ან Cr კონცენტრატის სახით.2THE3. ეს იმის გამო ხდება, რომ ქრომს შეუძლია შექმნას ფეროქრომის შენადნობი, ძირითადი წყარო. უჟანგავი ფოლადი და სხვა სპეციალური შენადნობები.
ქრომი, რომელიც, როგორც წესი, უჟანგავი ფოლადის 18%-ს შეადგენს, მნიშვნელოვნად ზრდის მდგრადობას ფოლადზე დაჟანგვის (კოროზიის) და სხვა ქიმიური შეტევების მიმართ. სხვა სპეციალურ შენადნობებში ქრომი ასევე თამაშობს როლს მასალების გამკვრივების, სიხისტისა და გამძლეობის გაზრდაში.

THE ცეცხლგამძლე მრეწველობა ის ასევე არის ქრომის კარგი მომხმარებელი, რადგან ქრომიტი არის ცნობილი ცეცხლგამძლე მასალა, ანუ მასალა, რომელსაც შეუძლია გაუძლოს თერმულ, ქიმიურ და ფიზიკურ ეფექტებს, რომლებიც წარმოიქმნება ინდუსტრიებში. ქრომიტი, რომელიც გამოიყენება ცეცხლგამძლე აგურის დასამზადებლად, ძალიან მდგრადია დეგრადაციის მიმართ, როდესაც ექვემდებარება გათბობას.
უკვე ქიმიური მრეწველობა ცდილობს გამოიყენოს ქრომი რამდენიმე გზით:
როგორც კატალიზატორი;
როგორც კოროზიის ინჰიბიტორი;
ქრომირებული საფარით;
პიგმენტებში;
შეღებვის ნაერთებში.
ცნობილია ქრომირებული საფარი, რომელიც შედგება ობიექტზე ქრომის დამცავი ფენის წარმოქმნისგან, რომელიც იცავს მას კოროზიისგან. ამ პროცესში, ქრომი დეპონირდება ობიექტზე, რომლის მეშვეობითაც უნდა მოხდეს ქრომირება ელექტროლიზი ქრომის III სულფატი, კრ2(მხოლოდ4)3, წარმოებული დაშლით კრ2THE3 ჰ2მხოლოდ4.
ქრომის პიგმენტები ძალიან გავრცელებულია, განსაკუთრებით სხვადასხვა ფერებით, რომელთა მიღებაც შესაძლებელია მათი ნაერთებით. ქრომის III ქლორიდის ჰექსაჰიდრატის დაშლისას, CrCl3·დილის 6 საათი2O, მიიღება იისფერი ხსნარი. მეორეს მხრივ, ქრომის III სულფატის დაშლისას კრ2(მხოლოდ4)3, მიიღება მწვანე ფერი.
ქრომის II ქლორიდის ხსნარი, CrCl2, ლურჯია, ხოლო ქრომის II აცეტატი, კრ2(COO)4, არის წითელი მყარი. ქრომის ოქსიდი II, CrO2, შავია; კალიუმის ქრომატი, კ2CrO4და ყვითელი; კალიუმის დიქრომატი, კ2ქრ2THE7და ფორთოხალი; კალიუმის ტრიქრომატი, კ2ქრ3THE10, წითელია; და ქრომის VI ოქსიდი, CrO3, ასევე წითელია.
საინტერესოა:ლალი სინამდვილეში ძვირფასი ქვებია, ალ2THE3, რომლებსაც კონსტიტუციაში აქვთ ქრომის კვალი. ეს ასევე ეხება ზურმუხტს, ბერილის ფორმას, რომლის მწვანე ფერი მცირე რაოდენობით ქრომის შედეგია.
ასევე იცოდე:ვოლფრამი — მონაცრისფრო ლითონი, რომლის ფერიც ფოლადს წააგავს
ქრომის ურთიერთობა ჯანმრთელობასთან
ქრომის ორ ჟანგვის მდგომარეობას აქვს ბიოლოგიური როლი. ვნახოთ შემდეგი.
→ ექვსვალენტური ქრომი (კრ6+)
რაც შეეხება ქრ6+, ცნობილია, რომ ეს შეიძლება იყოს ითვლება კანცეროგენადგანსაკუთრებით დიდი რაოდენობით შესუნთქვისას ან გადაყლაპვისას.
→ სამვალენტიანი ქრომი (კრ3+)
სამვალენტიანი ქრომი ყოველთვის იყო განიხილება აუცილებელი ელემენტი. ქრომის კვებითი დამატება ამ ფორმით პოპულარული გახდა არსებითი მიკროელემენტების ხელშეწყობისთვის და როგორც წონის დაკარგვის აგენტი. ასევე არსებობს დისკუსია, რომ სამვალენტიანი ქრომის შეყვანა საინტერესო იქნება სამკურნალოდ ტიპი 2 დიაბეტი, ასევე გესტაციური დიაბეტისთვის.
თუმცა, ზოგიერთი ავტორი აყენებს ეს არსებითობა განხილვის პროცესშია. აზრი არის ის, რომ ქრომი, დამატებული თუ არა, არავითარი მნიშვნელობა არ აქვს სხეულის შემადგენლობას. მეტაბოლიზმი აძლევს გლუკოზა ან ინსულინის მგრძნობელობა. ითვლება, რომ, ფაქტობრივად, ქრომის ყველაზე მაღალ დოზას აქვს ფარმაკოლოგიური და არაკვებითი ეფექტი, რაც მიუთითებს მას, როგორც აუცილებელ ელემენტად.
ქრომის ისტორია
სახელი ქრომი მომდინარეობს ბერძნულიდან ქრომა, რაც ნიშნავს ფერს. ამ ელემენტს სახელიც რომ დაერქვა, მისი აღმოჩენა მოხდაფრანგი ფარმაცევტი და ქიმიკოსი ლუი ნიკოლა ვაკელენი1797 წელს, როდესაც მან შენიშნა ქრომი ნიანგის მადნის შესწავლისას, PbCrO4. თუმცა, თავდაპირველად, მეტალს არ ჰქონია დიდი კომერციული წარმატება.
მისი აღმოჩენიდან თხუთმეტი წლის შემდეგ, მაგალითად, სერ ჰამფრი დევიმ არ იცოდა ბევრი რამ ქრომისა და მისი ნაერთების შესახებ, როდესაც დაწერა თავისი ცნობილი წიგნი. ქიმიური ფილოსოფიის ელემენტები, რაც მხოლოდ იმაზე მიუთითებს, რომ ქრომის მჟავას მომჟავო გემო ჰქონდა.
იმავე წელს იონს იაკობ ბერცელიუსმა დაწერა, რომ ტოქსიკური ქრომის მჟავის გემო უსიამოვნო და მეტალის იყო. ბერცელიუსმა გააცნობიერა, რომ ლითონი, მიუხედავად იმისა, რომ მყიფე იყო, საკმაოდ მდგრადია მისი მოქმედების მიმართ მჟავები და ატმოსფერული ჰაერი.
მიუხედავად იმისა, რომ თავდაპირველად არ იყო დიდი კომერციული წარმატება, მე-19 საუკუნის ბოლოს და მე-20 საუკუნის დასაწყისში, ელემენტი დაიწყო კომერციული გამოყენება, რადგან დაიწყო უჟანგავი ფოლადის ფართო გამოყენება, ასევე ნაწილების ქრომირებული მოოქროვება საავტომობილო ინდუსტრიაში, რაც ქრომს ლითონად აქცევს დიდ მოთხოვნად.
ქრომის ამოხსნილი სავარჯიშოები
კითხვა 1
(UEFS/BA)ქრომის ატომს აქვს ჟანგვის რიცხვი +3 სახეობებში
ა) კრ2THE3
ბ) CrO
გ) კრ
დ) CrO42-
ე) კრ2THE72-
რეზოლუცია:
ალტერნატივა ა
ასო C-ში ქრომი ჩანს როგორც მარტივი ნივთიერება, ასე რომ, ამ შემთხვევაში, NOx ნულის ტოლია.
THE ჟანგბადი დანარჩენ ნაერთებში გვხვდება NOx ტოლი -2. ამრიგად, ჩვენ შეგვიძლია გამოვთვალოთ ქრომის NOx ყველა სახეობაში, რაც მას უცნობია (x):
ქრ2THE3 → 2x + 3(-2) = 0 ⸫ x = +3
CrO → x + (-2) = 0 ⸫ x = +2
CrO42- → x + 4(-2) = -2 ⸫ x = +6
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
კითხვა 2
(UPE 2013) მეცნიერთა საერთაშორისო ჯგუფმა აღმოაჩინა რთული ქიმიური რეაქცია, რომელიც პასუხისმგებელია ზოგიერთის გაუარესებაზე ხელოვნების უდიდესი ნამუშევრები ისტორიაში, შესრულებული ვინსენტ ვან გოგის (1853–1890) და სხვა ცნობილი მხატვრების მიერ მე-20 საუკუნეში. XIX. გამოკვლევების დროს ამ მკვლევარებმა ხელოვნურად დაძველეს პიგმენტები და დაადგინეს, რომ ზედა ფენის დაბნელება დაკავშირებული იყო საღებავში არსებული ქრომის ცვლილებასთან Cr(VI)-დან Cr(III).
Ხელმისაწვდომია: http://agencia.fapesp.br/13455 (ადაპტირებული)
მონაცემები:Cr (Z = 24), ელექტრონული კონფიგურაცია: [Ar] 4s1 3D5
ზემოთ აღწერილი სიტუაციიდან გამომდინარე, ეს ასეა სწორიამტკიცებენ, რომ (
ა) Cr(VI) Cr(III)-მდე დაჟანგვამ გააფუჭა დიდი მხატვრული ნაწარმოებები ისტორიაში.
ბ) ჩარჩოების დაძველება დაკავშირებულია Cu-ს ელექტრონულ აგზნებასთანThe კრ3+.
გ) კრის შემცირების პროცესი6+ კრ3+ დაჩრდილა მე-19 საუკუნის ცნობილი ნაწარმოებები.
დ) მომხდარმა ტრანსფორმაციამ დაუჟანგა CuThe, პასუხისმგებელი ორიგინალური ნახატის ბრწყინვალებაზე.
ე) Cr(VI)-დან Cr(III) ცვლილება არის ქიმიური რეაქცია, რომელიც ხდება მხოლოდ მრავალი წლის შემდეგ.
რეზოლუცია:
ალტერნატივა C
Cr(VI)-დან Cr(III)-ზე გადასვლა არის პროცესი შემცირება (NOx-ის შემცირება), რაც ევალებოდა ეკრანების ჩაბნელებას.
სტეფანო არაუხო ნოვაისის მიერ
ქიმიის მასწავლებელი
