THE მაკარონიატომური, როგორც მისი სახელი გვთავაზობს, ეს არის ატომის მასა, რომელიც ჩვეულებრივ სიმბოლოა „მThe”ან ”MA”. თუმცა, ვინაიდან ატომი არის უკიდურესად პატარა არსება, უხილავი ადამიანის თვალისთვის, შეუძლებელია მისი მასის გაზომვა, მაგალითად, სასწორის გამოყენებით. ასე რომ, მეცნიერებმა დაადგინეს ატომების მასა სხვა ატომების მასებთან შედარებით.
ეს კეთდება სხვა ერთეულებთანაც. მაგალითად, მასის ერთეული არის სტანდარტული კილოგრამი, რომელიც შეესაბამება 3,917 სმ სიმაღლისა და დიამეტრის ცილინდრს, რომელიც დამზადებულია 10% ირიდიუმისგან და 90% პლატინისგან. ასე რომ, ის ემსახურება როგორც შედარებას. მაგალითად, თუ სასწორზე „ავწონით“ საგანს და აღმოვაჩენთ, რომ მისი მასა 10 კგ-ია, ეს ნიშნავს, რომ მისი მასა 10-ჯერ მეტია არჩეულ სტანდარტზე: 1 კგ.
იგივე ეხება ატომებს. არჩეული სტანდარტი იყო ნახშირბად-12 და ამ ატომს თვითნებურად მიენიჭა მასა 12 U. "u" არის ატომური მასის ერთეული და, შესაბამისად, უდრის ნახშირბადის ატომის მასის 1/12-ს.
მაგალითად, როდესაც ვამბობთ, რომ წყალბადის ატომური მასა უდრის 1 u-ს, ეს ნიშნავს, რომ თითქოს თუ ნახშირბადს გავყოფთ 12 ნაწილად, ამ ნაწილის მასა უდრის ატომის მასას. წყალბადის. კიდევ ერთი მაგალითია გოგირდი, მისი ატომური მასა არის 32 u, რაც ნიშნავს, რომ მისი მასა 32-ჯერ აღემატება მასის 1/12-ს.
12ჩ.1 u = 1 ნახშირბადის 12 ატომის მასის 1/12

ატომური მასის ერთეული არის ნახშირბად-12-ის მასის 1/12
ნივთიერებების მოლეკულური მასა არის ელემენტების ატომური მასების ჯამი. მაგალითად, ჟანგბადის ატომური მასა უდრის 16 u-ს, ამიტომ ჟანგბადის გაზის მოლეკულის მოლეკულური მასა (O2) უდრის 32u.
ვინაიდან ლაბორატორიული ტექნიკა ამჟამად ძალიან მოწინავეა, არსებობს მოწყობილობები, რომლებიც ზუსტად ზომავენ ელემენტების ატომურ მასას, როგორიცაა მასის სპექტრომეტრი. ამრიგად, ამის ცოდნა შესაძლებელია 1 u უდრის 1.66054-ს. 10-24 გ.
გონების რუკა: ატომური მასა

* გონების რუკის PDF-ში გადმოსაწერად, Დააკლიკე აქ!
ვინაიდან ატომური მასები განისაზღვრება დიდი სიზუსტით, ისინი მოცემულია პერიოდულ ცხრილში ათობითი რიცხვების სახით. მაგრამ როდესაც ჩვენ მივდივართ გამოთვლების გასაკეთებლად, ჩვენ ჩვეულებრივ ვიყენებთ მომრგვალებულ რიცხვს, გარდა ექსპერიმენტებისა, რომლებიც ძალიან ზუსტი უნდა იყოს. მაგალითად, თუ გადავხედავთ პერიოდულ ცხრილს, ნახავთ, რომ ჟანგბადის ატომური მასა უდრის 15,999 u, მაგრამ ჩვენ ჩვეულებრივ ვიყენებთ მნიშვნელობას 16 u გამოთვლებში. ეს ხდება ნახშირბადთანაც, რომლის ატომური მასა მოცემულია 12.01 u-ით, როგორც ეს ნაჩვენებია ქვემოთ:
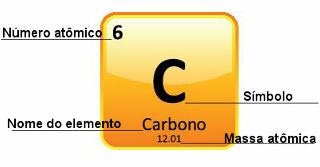
ნახშირბადის წარმოდგენა პერიოდულ ცხრილში
პერიოდულ ცხრილში მოყვანილი ელემენტები რეალურად არის ყველა ელემენტის ბუნებრივი იზოტოპების შეწონილი საშუალო. ამრიგად, ატომური მასა, რომელიც მოცემულია ცხრილში, ასევე არის ამ ელემენტების ატომური მასების საშუალო. მაგალითად, ქლორს (C?) აქვს ორი ბუნებრივი იზოტოპი, 35 და 37, რომელთა შესაბამისი პროცენტები ბუნებაში არის 75,76% და 24,24%. თითოეული ამ იზოტოპის ატომური მასა განსხვავებულია, C?-35 არის 34,96885 u და C?-37 არის 36,96590.
ამგვარად, ელემენტის ატომური მასა გამოითვლება თითოეული იზოტოპის მასისა და სიმრავლის გათვალისწინებით, რომლითაც იგი ჩნდება ბუნებაში. ქლორის შემთხვევაში გვაქვს:
ქლორის ელემენტის ატომური მასა = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
ქლორის ელემენტის ატომური მასა = 35,45
ეს არის ქლორის ატომური მასის მნიშვნელობა, რომელიც ნაჩვენებია პერიოდულ ცხრილში.
* გონების რუკა ჩემი დიოგო ლოპესის მიერ
ჯენიფერ ფოგაჩას მიერ
დაამთავრა წერილები
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm


