რედოქსის რეაქციების მთავარი განმასხვავებელი თვისება ის არის, რომ ერთდროულად ერთი ქიმიური სახეობა კარგავს ელექტრონებს (დაჟანგვით) და მეორე იძენს ელექტრონებს (შემცირებით).
თუმცა, გარკვეულ რეაქციებში შესაძლებელია დაკვირვება, რომ არ არის მხოლოდ დაჟანგვა და/ან შემცირება. ქვემოთ მოცემულია მაგალითი:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2ო
ამ რეაქციაში ყველა ატომის დაჟანგვის რიცხვების (Nox) გამოთვლა, როგორც ეს ნასწავლია ტექსტში „ჟანგვის ნომრის (ნოქსი) განსაზღვრა“, გვაქვს:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2ო
ახლა შევამოწმოთ რომელინივთიერებები განიცდიდნენ ცვალებადობას მათ Nox-ში და, შესაბამისად, იჟანგება და მცირდებოდა:
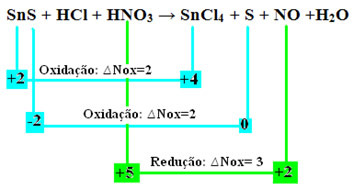
გაითვალისწინეთ, რომ მოხდა ორი დაჟანგვა. მაშ, ამ შემთხვევაში, როგორ დავაბალანსოთ ქიმიური განტოლება?
ერთი მნიშვნელოვანი რამ, რაც უნდა გვახსოვდეს, რომელიც ეხება ყველა რედოქს რეაქციას, არის ის გაცემული ელექტრონების რაოდენობა ყოველთვის უნდა იყოს მიღებული ელექტრონების რაოდენობის ტოლი.
ამიტომ, ამ ტიპის რეაქციის დასაბალანსებლად, დაიცავით ტექსტში დადგენილი იგივე წესები "
რედოქსის დაბალანსება”, თუმცა, მხოლოდ ერთი ცვლილებით: იმ სახეობების Nox ვარიაციის (∆Nox) განსაზღვრა, რომლებმაც გამოიმუშავეს ორი დაჟანგვა (SnS) იქნება ორი ∆Nox-ის ჯამი, რომელიც მოგვცემს დაკარგული ელექტრონების მთლიან მნიშვნელობას:- SnS: ∆Total Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆სულ NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
ამრიგად, ჩვენ შეგვიძლია გავაგრძელოთ შემდეგი ნაბიჯები დაბალანსებისთვის:
- SnS: ∆სულ NOx = 4 → 4 იქნება HNO კოეფიციენტი3;
- HNO3: ∆Nox = 3 → 3 იქნება SnS-ის კოეფიციენტი.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NO + H2ო
დაბალანსების გაგრძელება საცდელი მეთოდით:
- ვინაიდან პირველ წევრში გაქვთ 3 Sn და 3 S, ეს იქნება თქვენი კოეფიციენტები მე-2 წევრში:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+არა+H2ო
- ამასთან, მე-2 წევრს დარჩა 12 Cl (3. 4 = 12), ასე რომ 12 იქნება იმ ნივთიერების კოეფიციენტი, რომელშიც Cl გვხვდება პირველ წევრში, რომელიც არის HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +H2ო
- ჩვენ ახლა გვაქვს 16 H პირველ წევრში (12 + 4 = 16), შესაბამისად H-ის კოეფიციენტი2O იქნება 8-ის ტოლი, რადგან 8 გამრავლებული წყალბადის ინდექსზე, რომელიც არის 2, იძლევა 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8ჰ2ო
- გარდა ამისა, პირველ წევრში ასევე არის 4 N, ამიტომ 4 ასევე იქნება N-ის კოეფიციენტი მე-2 წევრში:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2ო
გაითვალისწინეთ, რომ ჟანგბადის რაოდენობა პირველ კიდურში (3. 4 = 12) უდრის ამ ელემენტის მთლიან რაოდენობას მე-2 კიდურში (4 + 8 = 12). ასე რომ, რეაქცია დაბალანსებულია.
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმიის განხრით
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm
