აირების ეს ნარევი წარმოშობს ერთგვაროვან ნარევებს ან აირისებრ ხსნარებს. მაგალითად, აირები, რომლებიც გამოდის ქარხნის ბუხრებიდან, ან მანქანის გამონაბოლქვიდან, ვრცელდება ჰაერში. ატმოსფერული და, დროთა განმავლობაში, ჩვენ ვეღარ შევძელით მათი გარჩევა, რადგან ხდებოდა ამ აირების დიფუზია საჰაერო.

საკვამურებიდან გამოსხივებული აირები დიფუზური და „იკარგება“ ატმოსფერულ ჰაერში, რადგან ჰაერის მოცულობა გაცილებით მეტია, ვიდრე კვამლის.
| THE დიფუზია აირის გაზის სპონტანური მოძრაობა მეორეში, ანუ მისი გავრცელება სხვა აიროვან გარემოში. |
| THE ეფუზია გაზები არის დიფუზიის განსაკუთრებული ტიპი, რომლის დროსაც ხდება გაზების გაჟონვა მცირე ხვრელების მეშვეობით (ან ფოროვანი კედლებით, რაც წარმოადგენს პატარა ხვრელების ერთობლიობას). |
მაგალითად, ბავშვებისთვის გაყიდული ბუშტები ივსება ჰელიუმის გაზით. დროთა განმავლობაში ეს გაზი მთავრდება ბურთის რეზინის ფორებში გავლისას, ანუ ხდება მისი გამონაყარი. ამას აჩვენებს ის ფაქტი, რომ ბუშტი იშლება რამდენიმე საათის შემდეგ.
შოტლანდიელმა ქიმიკოსმა თომას გრემმა 1829 წელს შეისწავლა გაზების ეს ქცევა. მან დაასკვნა, რომ სიჩქარე, რომლითაც გაზი გადის სხვაში, დაკავშირებულია მის სიმკვრივესთან. როდესაც მისი ექსპერიმენტული მონაცემები განმეორდა ყველა გაზისთვის, მან შექმნა შემდეგი კანონი, რომელიც ატარებს მის სახელს:
გრეჰემის კანონი: გაზის დიფუზიის ან გაჟონვის სიჩქარე მისი სიმკვრივის კვადრატული ფესვის უკუპროპორციულია.
მათემატიკურად, ეს კანონი შეიძლება გამოისახოს განტოლებით:
v α 
ან ორი განსხვავებული აირის დაკავშირებისას გვაქვს:
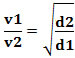
ამ შემთხვევაში გამოყენებული ერთეული არის „მოცულობა, რომელიც გადის დროის ერთეულზე“; ამიტომ ზოგადად ლ/წთ (ლიტრი წუთში).
ამრიგად, დაბალი სიმკვრივის გაზები უფრო სწრაფად ვრცელდება. თუ ის იმავე ტემპერატურისა და წნევის მდგომარეობაშია, შეგიძლიათ ამის ურთიერთობა მასასთანაც გაზის მოლარი: რაც უფრო დიდია გაზის სიმკვრივე, მით მეტია მისი მოლური მასა და უფრო დაბალია მისი სიჩქარე. დიფუზია; და პირიქით. ამრიგად, ჩვენ გვაქვს:
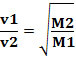
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმიის განხრით
ბრაზილიის სკოლის გუნდი
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm
