საათზე ჰიდრატაციის რეაქციები ალკადიანები ისინი არიან დამატებით რეაქციებს, ანუ წყლის მოლეკულის კომპონენტები (ჰიდრონიუმი და ჰიდროქსიდი) ემატება ალკადიენს.
შენ ალკადიანები ნახშირწყალბადები, რომლებსაც აქვთ ღია ჯაჭვი და ორი ორმაგი ბმა (წარმოქმნილია სიგმით და პი) ნახშირბადებს შორის, როგორც ვხედავთ შემდეგ სტრუქტურაში:

ალკადიენის სტრუქტურული ფორმულა
სთვის ჰიდრატაციის რეაქცია ალკადიენებში ხორციელდება, აუცილებელია პი ობლიგაცია, რომელიც ორმაგ კავშირშია, გატეხილი იყოს სითბოს და გოგირდმჟავას ზემოქმედებით (H2მხოლოდ4). პი ბმის გაწყვეტასთან ერთად ჩნდება ობლიგაციის ორი ადგილი, თითოეული ორმაგ კავშირში მონაწილე ერთ-ერთ კარბონზე.

სავალდებულო ადგილების გაჩენა პი სავალდებულოობის დარღვევით
ალკადიენის მოლეკულაზე სავალდებულო ადგილების გამოჩენა აუცილებელია იონებისთვის (H+ და ოჰ-) წყალიდან ემატება ალკადიენი და წარმოიქმნება, მაგალითად, დიალკოჰოლი (ალკოჰოლი ორი ჰიდროქსილით).
ჰ-ს დამატება+ და ოჰ- ალკადიენის სტრუქტურაში
ᲨᲔᲜᲘᲨᲕᲜᲐ: H- ს დამატება+ და ოჰ- ალკადიენის სტრუქტურაში შემდეგია მარკოვნიკოვის წესი, ანუ H+ უკავშირდება ყველაზე წყალბადის ნახშირბადს და OH- ს- უერთდება ნაკლებად ჰიდროგენული ნახშირბადს.

მარკოვნიკოვის წესის გამოყენების მაგალითი ალკადიენების ჰიდრატაციაში
რადგანაც არსებობს სხვადასხვა ტიპის ალკადიენი ორმაგი ობლიგაციების პოზიციის მიმართ, შეიძლება ალკადიენის ჰიდრატაცია წარმოქმნას სხვადასხვა ნაერთები. იხილეთ შემდეგი შემთხვევები:
→ დაგროვილი ან შედედებული ალკადიენი
ეს არის ალკადიენი, რომელსაც აქვს ორი ორმაგი ბმა ერთდროულად, რომელშიც ჩართულია სამი ატომი ნახშირბადი, ანუ არ არსებობს ერთი ბმა, რომელიც გამოყოფს ობლიგაციებში მონაწილე ნახშირბადებს ორჯერ.

დაგროვილი ალკადიენის სტრუქტურული ფორმულა
ალტერნატიული ალკადიენის ჰიდრატაციის რეაქციის დროს პი ბმულები იშლება, წარმოადგენს H- ს+ დაემატა უფრო მეტ ჰიდროგენიზებულ ნახშირბადებს და OH- ნაკლებად ჰიდროგენიზებულ ნახშირბადებს დაემატა:
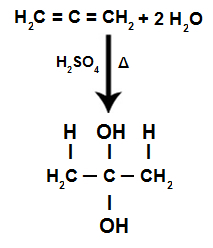
დაგროვილი ალკადიენის ჰიდრატაციის რეაქციის განტოლება
ჩვენ გვაქვს, რომ დაგროვილი ალკადიენის ჰიდრატაციისას, ნახშირბადის იგივე ატომი იღებს ორ ჰიდროქსილს, ქმნის ტყუპ ალკოჰოლს, რომელიც არასტაბილური სტრუქტურაა.

ტყუპების სტრუქტურა ჩამოყალიბდა ალკოჰოლი
რადგან ტყუპ ალკოჰოლი არასტაბილურია, ჩვენ გვაქვს წყლის მოლეკულის წარმოქმნა ორი ჰიდროქსილის კომპონენტებით და წარმოქმნის პი ბმას ნახშირბადსა და ჟანგბადს შორის.

კეტონის ფორმირება ტყუპ ალკოჰოლთან
ამიტომ, დაგროვილი ალკადიენების ჰიდრატაციის რეაქცია გამოიწვევს ა კეტონი.
→ კონიუგირებული ან ალტერნატიული ალკადიენი
ეს არის ალკადიენი, რომელსაც აქვს ორი ორმაგი ბმა, ერთდროულად ოთხი ნახშირბადის ატომები, ანუ არსებობს ერთი ბმა, რომელიც ჰყოფს ობლიგაციებში მონაწილე ნახშირბადებს ორჯერ.
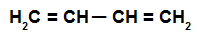
მონაცვლე ალკადიენის სტრუქტურული ფორმულა
ალკადიენების მონაცვლეობისას ხდება მათი ორმაგი ობლიგაციების რეზონანსი. ამრიგად, პი ბმის ელექტრონები ცვლის პოზიციას (წითელი ისრები), როგორც შემდეგ დიაგრამაზე:
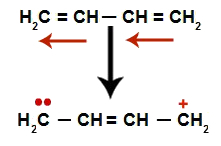
ალტერნატიულ ალკადიენში რეზონანსის ამსახველი სქემა
ზოგადად, ორმაგი ბმის გამოჩენა გვაქვს ზუსტად იმ ნახშირბადებს შორის, სადაც ადრე ორი ორმაგი იყო და ორი შემაკავშირებელი საიტის შექმნა, თითო ნახშირბადზე, რომელიც აღარ ქმნის ორმაგ კავშირს (მაგალითად, ნახშირბადები 1 და 4). ჯაჭვის 1 და 4 ნახშირბადები მიიღებენ H- ს+ და ოჰ- წყლიდან.

ნაწილობრივი დატენიანება ალკადიენის მონაცვლეობით
რეზონანსის შემდეგ, ახალი ორმაგი ბმის პი კავშირი გაწყვეტილია და H+ და ოჰ- ემატება ალკადიენის მოლეკულას. OH ემატება ნახშირბადის უახლოეს პირველ დამატებულ OH ჯგუფს, რადგან იგი განიცდის ჯგუფის ელექტრონულ მიზიდვას, რაც უფრო ელექტრონეგატიურია.

ჰიდრატაციის შეწყვეტა ალტერნატიულ ალკადიენში
რეზონანსის გამო, ჩვენ ვამბობთ, რომ ალკადიენმა მონაცვლეობით განიცადა 1.4 დატენიანება და წარმოქმნა დიალკოჰოლი.
→ ალკადიენის იზოლირება
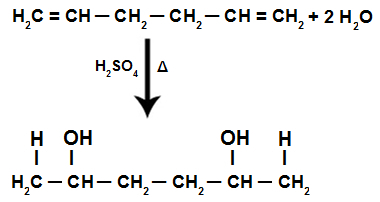
ეს არის ალკადიენი, რომელსაც აქვს ორი ორმაგი ბმა, რომელშიც ერთდროულად მონაწილეობს სულ მცირე ხუთი ატომი. ნახშირბადის, ანუ მინიმუმ ორი ერთჯერადი ბმა ჰყოფს ობლიგაციებში მონაწილე ნახშირბადებს ორჯერ.

იზოლირებული ალკადიენის სტრუქტურული ფორმულა
იზოლირებული ალკადიენის ჰიდრატაციის რეაქციის დროს პი ბმულები იშლება, H+ დაემატა უფრო მეტ ჰიდროგენიზებულ ნახშირბადებს და OH- დაემატა ნაკლებად ჰიდროგენიზებულ ნახშირბადებს.

იზოლირებული ალკადიენის ჰიდრატაციის რეაქციის განტოლება
ამიტომ, იზოლირებული ალკადიენის დამატებით, ჩვენ მხოლოდ დიაალკოჰოლის წარმოქმნა გვაქვს.
ჩემ მიერ. დიოგო ლოპეს დიასი
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/reacoes-hidratacao-alcadienos.htm
