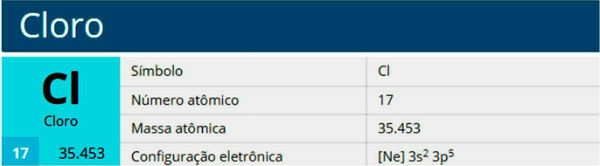
ქლორი არის ქიმიური ელემენტი სიმბოლოთი Cl, ატომური ნომერი 17, ატომური მასა 35,5. იგი მიეკუთვნება ჰალოგენთა ოჯახს, ჯგუფს 17 ან 7A და პერიოდული ცხრილის მესამე პერიოდს.
მისი სახელი ბერძნულიდან მომდინარეობს ხლოროსი, რაც მომწვანოს ნიშნავს. ეს იმიტომ ხდება, რომ ტემპერატურისა და წნევის ნორმალურ პირობებში ქლორს ახასიათებს მწვანედ მოყვითალო ფერის გაზი ძლიერი სუნით.
მახასიათებლები
ქლორი 1774 წელს აღმოაჩინა შვედმა მეცნიერმა კარლ ვილჰელმ შეელმა (1742-1786). ამასთან, იმ დროს მე მჯეროდა, რომ ეს იყო ჟანგბადის შემცველი ნაერთი. 1810 წელს ჰამფრი დევიმ (1778-1829) აჩვენა, რომ ეს ახალი ქიმიური ელემენტია.
ვინაიდან ის ძალზე რეაქტიული ელემენტია, იგი ბუნებაში თითქმის არ გვხვდება მისი სუფთა სახით, გარდა მცირე რაოდენობით, რომელიც გამოიყოფა ვულკანური ამოფრქვევების დროს HCl- ის სახით.
ამრიგად, იგი ჩვეულებრივ გვხვდება ნატრიუმის ქლორიდის (NaCl) სახით, ასევე ცნობილი როგორც სუფრის მარილი. მინერალებში ეს გვხვდება კარნალიტისა და სილვიტის სახით.
მისი მიღება ასევე შესაძლებელია ელექტროლიზი NaCl, წყალხსნარში. ქლორი ასევე აწარმოებს ბევრ მარილს ქლორიდებისგან პროცესის საშუალებით დაჟანგვა.
შეიტყვეთ მეტი, წაიკითხეთ აგრეთვე:
- Პერიოდული ცხრილი
- ქიმიური ელემენტები
- ჰალოგენები
პროგრამები
ქლორის გაზი (Cl2) არის ტოქსიკური და გამაღიზიანებელი, ამ მდგომარეობამ განაპირობა ის, რომ იგი გამოყენებული იქნა როგორც ქიმიური იარაღი პირველი მსოფლიო ომის დროს. ეს გაზი იწვევს სასუნთქი გზების და კანის გაღიზიანებას, ფილტვებში წყლის შეკავებას, ცრემლსადენი და დიდი რაოდენობით ჩასუნთქვისას შეიძლება გამოიწვიოს სიკვდილი.
ქლორის ზოგიერთი სხვა გამოყენებაა:
- ქაღალდისა და ქსოვილების გაუფერულება ქლორის დიოქსიდის (ClO) გამოყენებით2).
- წყლის გაწმენდა, ქლორის დამატება ქმნის წყალს სასმელად და ვარგისია ადამიანის საკვებად. ამ პროცესს ქლორირება ჰქვია და გამოიყენება ჰიპოქლორინის მჟავა (HClO).
- საცურაო აუზების წყლისა და სამრეწველო ნარჩენების დეზინფექცია, რადგან ქლორს შეუძლია მიკროორგანიზმების მოკვლა.
- პლასტმასის ნაერთების, როგორიცაა PVC (პოლივინილის ქლორიდი) და სინთეზური რეზინის წარმოება.
- ზოგიერთი სახის ორგანული და არაორგანული ნაერთების წარმოება.