Კოვალენტური ბმა არის ურთიერთქმედების ტიპი ატომებს შორის, რომლებსაც აქვთ მაღალი ელექტრონეგატიურობა, ეს არის ელექტრონების მიღების მაღალი ტენდენცია. ქიმიური ელემენტები, რომლებიც ჩვეულებრივ მონაწილეობენ ამ ტიპის ბმულებში, არის:
წყალბადის (H)
ბერილიუმი (იყავი)
ბორი (B)
ნახშირბადი (C)
აზოტი (N)
ფოსფორი (P)
ჟანგბადი (O)
გოგირდი (S)
ფტორი (F)
ქლორი (Cl)
ბრომი (Br)
იოდი (I)
ა) ჩართული ელემენტების ხასიათი
ქიმიური ელემენტები, რომლებსაც აქვთ მაღალი ელექტრონეგატივი და, შესაბამისად, ახდენენ კოვალენტურ კავშირებს:
წყალბადის
მეტალები
ბ) კოვალენტური კავშირის წარმოქმნა
კოვალენტურ კავშირში მონაწილე ქიმიური ელემენტების ხასიათიდან გამომდინარე, ეს შეიძლება მოხდეს შემდეგნაირად:
წყალბადის ორ ატომს შორის;
არა ლითონის ატომსა და წყალბადს შორის;
ერთი და იგივე ქიმიური ელემენტის ატომებს შორის (არამეტალური);
სხვადასხვა ქიმიური ელემენტის ატომებს შორის (ორივე არამეტალი).
გ) თითოეულ ატომს უნდა მიიღოს ელექტრონების რაოდენობა
ელექტრონების რაოდენობა, რომელსაც თითოეული არამეტალი ან წყალბადის ატომი იღებს ობლიგაციაში, დაკავშირებულია ოქტეტების წესი.
ოქტეტის წესის თანახმად, ატომი სტაბილურია, როდესაც იგი ვალენტურ გარსში იძენს რვა ან ორ ელექტრონს (მხოლოდ წყალბადის შემთხვევაში). მაგალითად, თუ ატომს აქვს ხუთი ელექტრონი ვალენტურ გარსში, მან უნდა მიიღოს სამი ელექტრონი სტაბილურობის მისაღწევად.
შენიშვნა: ბერილიუმი და ბორი არის ოქტეტის წესის გამონაკლისები, რადგან ისინი სტაბილურები ხდებიან, შესაბამისად, 4 და 6 ელექტრონი ვალენტურ გარსში.
ელექტრონული რაოდენობის ვალენტურ გარსში ადვილად შეიძლება განისაზღვროს ქიმიური ელემენტების ოჯახის ანალიზი. ქვემოთ მოცემულ ცხრილში, ჩვენ გვაქვს ელექტრონების რაოდენობა ვალენტურ გარსში, რომელიც ეხება იმ ოჯახს, რომელსაც ეკუთვნის ელემენტი და ელექტრონების რაოდენობა, რომელთა მიღებაც საჭიროა სტაბილურობის მისაღწევად:

დ) კოვალენტური კავშირის პრინციპი
როგორც კოვალენტური კავშირი, ყველა ჩართულ ატომს აქვს ელექტრონული მიღების ტენდენცია, მათ შორის იქნება ვალენსიის გარსში არსებული ელექტრონების განაწილება (ბირთვიდან ყველაზე შორეული დონე).
გაზიარება ხდება მაშინ, როდესაც ატომის ვალენტური გარსიდან ელექტრონი ხდება იმავე ელექტრონული ღრუბლის ნაწილი, რომელიც გარს აკრავს სხვა ელექტრონს სხვა ატომის ვალენტური გარსიდან.
წყალბადის თითოეულ ატომს, მაგალითად, აქვს ელექტრონი ვალენტობის გარსში. როდესაც ორი ელექტრონი ხდება ერთი და იგივე ღრუბლის ნაწილი, თითოეულ წყალბადში იწყება ორი ვალენტური ელექტრონი, ანუ ის სტაბილურია.
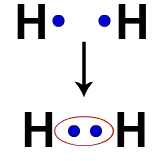
ორი წყალბადის ატომის ელექტრონები, რომლებიც ერთსა და იმავე ელექტრონულ ღრუბელს იკავებენ
ე) კოვალენტური შეერთების დროს გამოყენებული ფორმულები
1ª) მოლეკულური ფორმულა
ეს არის თითოეული ელემენტის ატომების რაოდენობის მითითება, რომლებიც ქმნიან კოვალენტური ბმებიდან წარმოშობილ მოლეკულას.
მაგალითი: ჰ2ო
წყლის მოლეკულაში გვაქვს წყალბადის 2 ატომი და 1 ჟანგბადის ატომი.
2ª) სტრუქტურული ფორმულა
სტრუქტურული ფორმულა არის მოლეკულის ორგანიზაციის დემონსტრირება, ანუ ის აჩვენებს ატომებს შორის კავშირებს. ამისათვის გამოიყენება ტიპები, რომლებიც წარმოადგენს თითოეული ატომის ბმას:
მარტივი (?): მიუთითებს იმაზე, რომ ატომს თავისი ვალენტური გარსიდან მხოლოდ ერთი ელექტრონი ჰქონდა სხვა ატომთან და პირიქით;
ორმაგი (?): მიუთითებს იმაზე, რომ ატომმა თავისი ვალენტური გარსიდან ორი ელექტრონი გაიზიარა სხვა ატომთან და პირიქით;
სამმაგი (≡): მიუთითებს იმაზე, რომ ატომს თავისი ვალენტური გარსიდან სამი ელექტრონი გაუნაწილა სხვა ატომთან და პირიქით.
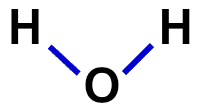
წყლის სტრუქტურული ფორმულა
3ª) ლუისის ელექტრონული ფორმულა
ლუისის ელექტრონული ფორმულა ასევე წარმოადგენს მოლეკულის ორგანიზაციას (ელექტრონული ფორმულა), მაგრამ ის მიზნად ისახავს ატომებში ელექტრონების განაწილების დემონსტრირებას.
მისი ასაშენებლად საკმარისია პატივი სცეს სტრუქტურულ ფორმულაში შემოთავაზებულ ორგანიზაციას და ობლიგაციების თითოეული კვალი (ერთი, ორმაგი ან სამმაგი) ჩაანაცვლოს "ორი ბურთულით", რომლებიც წარმოადგენს ელექტრონებს.
მაგალითად, წყლის სტრუქტურულ ფორმულაში გვაქვს ორი მარტივი კავშირი წყალბადებსა და ჟანგბადს შორის. ამრიგად, მათ შორის, ჩვენ მხოლოდ ორი ბურთი გვექნება, ელიფსით გამიჯნული (რომელიც წარმოადგენს ელექტრონულ ღრუბელს).
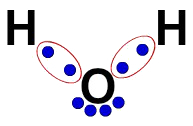
ლუისის წყლის ელექტრონული ფორმულა
ჩემ მიერ. დიოგო ლოპეს დიასი
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm
