სტაბილურობის მისაღწევად ზოგიერთ ნაერთს არ უნდა ჰქონდეს რვა ელექტრონი ვალენტურ გარსში, ამიტომ ისინი განიხილება ოქტეტის წესის გამონაკლისებად. ახლა გაიგეთ, რატომ გაურბის ზოგიერთი ელემენტი ელექტრონულ ოქტეტის უკანასკნელ გარსში ყოფნის ვალდებულებას.
ბერილიუმი (იყავი)
ეს არის გამონაკლისი ოქტეტის წესისაგან, რადგან მას შეუძლია შექმნას ნაერთები ორი ერთი ბმით, ამიტომ იგი სტაბილურია მხოლოდ ოთხი ელექტრონით ვალენტური გარსით. 
მას შემდეგ, რაც წყალბადს (H) კავშირის დასადგენად საჭიროა ორი ელექტრონის დათმობა (H - კარგად - H), ბერილიუმის (Be) ატომი იზიარებს მის ელექტრონებს და აღწევს სტაბილურობას.
ალუმინის (ალ)
ეს არის გამონაკლისი ოქტეტის წესისგან, რადგან იგი მიაღწევს სტაბილურობას ექვსი ელექტრონით ვალენტურ გარსში. ალუმინის ატომი თავისი ელექტრონების გაჩუქებას ცდილობს და ამიტომ შეუძლია შექმნას სამი ერთი ბმა სხვა ატომებთან: 
ამ შემთხვევაში, ალუმინმა (Al) შექმნა სამი ბმა სამი ფტორის (F) ატომით.
ბორი (B)
იგი ქმნის მოლეკულურ ნივთიერებებს სამი ერთი ბმით. 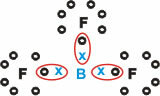
გაითვალისწინეთ, რომ ბორი (B) ცდილობს თავისი ელექტრონები დაუთმოს ფტორს (F) ატომებს, რომლებიც ემორჩილებიან ოქტეტის წესს, რომელიც მოითხოვს რვა ელექტრონს ვალენტურ გარსში. როგორც ბორი თავის ელექტრონებს უთმობს, წარმოქმნილი ოქტეტით ხდება ფტორის სტაბილიზაცია.
ლირია ალვესის მიერ
დაამთავრა ქიმია
ბრაზილიის სკოლის გუნდი
ნუ გაჩერდები ახლა... რეკლამის შემდეგ მეტია;)
Მეტის ნახვა!
ოქტეტის თეორია
ზოგადი ქიმია - Ქიმია - ბრაზილიის სკოლა
გსურთ მიუთითოთ ეს ტექსტი სასკოლო ან აკადემიურ ნაშრომში? შეხედე:
სოუზა, ლირია ალვესი დე. "გამონაკლისები ოქტეტის წესში"; ბრაზილიის სკოლა. Ხელმისაწვდომია: https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm. წვდომა 2021 წლის 27 ივნისს.


