კლაპეირონის განტოლება არის მათემატიკური გამოთქმა, რომელიც უკავშირდება ისეთ სიდიდეებს, როგორიცაა ზეწოლა (P), მოცულობა (V), ტემპერატურა (T) და ნაწილაკების რაოდენობა (n), რომლებიც ა სრულყოფილი ან იდეალური გაზი. ამ განტოლებას ფრანგი ფიზიკოსის სახელი მიენიჭა პავლეემილიკლაპეირონი და შეიძლება გავიგოთ, როგორც ემპირიული კანონების განზოგადება გაზებისრულყოფილიწელსგეი-ლუსაკი, ჩარლზ და ბოილი. ეს ფუნდამენტური იყო იდეალური გაზების შესწავლისთვის და საშუალებას აძლევდა ევოლუციას თერმული მანქანები, რაც მათ უფრო და უფრო ეფექტურს ხდის ბოლო რამდენიმე ათწლეულის განმავლობაში.
იხილეთ აგრეთვე: ფიზიკის აღმოჩენები, რომლებიც შემთხვევით მოხდა
კლაპეირონის განტოლება: იდეალური გაზის კანონი
კლაპეირონის განტოლებაა გამომდინარეობს სამი ემპირიული კანონიდან, ანუ კანონები, რომლებიც ექსპერიმენტებით განისაზღვრა. ასეთი კანონები ხსნის გაზების ქცევას გაზის გარდაქმნებიიზოვოლმეტრული (გეი-ლუსაკის კანონი), იზობარული (ჩარლზის კანონი) და იზოთერმები (ბოილის კანონი). ამ კანონების თანახმად:
გარდაქმნებში იზოვოლმეტრული, იდეალური გაზის წნევასა და თერმოდინამიკურ ტემპერატურას შორის თანაფარდობა რჩება მუდმივი;
გარდაქმნებში იზობარული, იდეალური გაზის მოცულობასა და თერმოდინამიკურ ტემპერატურას შორის თანაფარდობა მუდმივია;
- გარდაქმნებში იზოთერმები, იდეალური გაზის წნევისა და მოცულობის პროდუქტი მუდმივი რჩება.
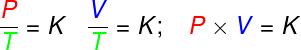
პ - წნევა (პა - პასკალი)
ვ - გაზის მოცულობა (მ 2)
თ - თერმოდინამიკური გაზის ტემპერატურა (K - კელვინი)
ზემოთ მოცემული სამი კანონიდან კლაპეირონის განტოლება განსაზღვრავს, თუ რა მნიშვნელობა აქვს ამას მუდმივი (კ) მიღებული თითოეულ ზემოხსენებულ გარდაქმნაში. კლაპეირონის განტოლების თანახმად, ეს მუდმივი ტოლია მოლების რაოდენობის გამრავლებული a- ზე მუდმივი რ, ცნობილია როგორც იდეალური აირების უნივერსალური მუდმივა და ტოლია ბოლცმანის მუდმივა გამრავლებული ავოგადროს ნომერი.
ფორმულა
გაეცანით ფორმულას, რომელიც ცნობილია, როგორც განტოლებაწელსკლაპეირონი:
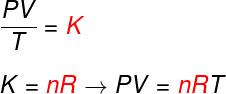
არა - მოლების რაოდენობა (მოლი)
რ - იდეალური აირების უნივერსალური მუდმივა (R = 0,082 ატ. ლ / მოლი. K ან 8.314 J.mol / K)
კლაპეირონის განტოლების ანალიზი, შესაძლებელია დაინახოს, რომ ზეწოლა ახდენს იდეალური გაზები ტემპერატურის პირდაპირპროპორციული და ასევე მოლების რაოდენობა. გარდა ამისა, წნევა მოცულობის უკუპროპორციულია გაზით დაკავებული.
ნუ გაჩერდები ახლა... რეკლამის შემდეგ მეტია;)
ო გაზის იდეალური მოდელი კლაპეირონის განტოლებით შესაძლებელი გახდა მანქანების განვითარება, რომლებიც იკვებება სითხეები, როგორიცაა ორთქლზე მომუშავე მანქანები და შიდა წვის ძრავები.
რამდენიმე მნიშვნელოვანი შედეგის მიღება შეიძლება კლაპეირონის განტოლებიდან. მაგალითად, ერთ-ერთი მათგანი პროგნოზირებს, რომ 1 მოლი ნებისმიერი იდეალური გაზი იკავებს მოცულობას 22,4 ლ როდესაც ექვემდებარება ზეწოლას 1 ატმოსფერო (1,01.105 პა) და ტემპერატურაზე 273 კ (0 ° C)
იხილეთ აგრეთვე: ყველაზე მნიშვნელოვანი ცნებები თერმოლოგიაში
გადაჭრილი სავარჯიშოები კლაპეირონის განტოლებაზე
კითხვა 1 - (UECE) გაზს, რომელსაც შეუძლია ჰქონდეს თავისი ტემპერატურა, მოცულობა და წნევა დაკავშირებული PV = nRT– ით, აქვს შემდეგი მახასიათებლები:
ა) მოლეკულებს შორის ძალიან დიდი საშუალო მანძილი, მოლეკულური ურთიერთქმედების უგულებელყოფის მიზნით, გარდა შეჯახებისა; მოლეკულები ელასტიურ შეჯახებებს განიცდიან.
ბ) ძალიან მცირე საშუალო მანძილი მოლეკულებს შორის; მოლეკულები განიცდიან არაელასტიკურ შეჯახებებს.
გ) ძალიან დიდი საშუალო მანძილი მოლეკულებს შორის, მოლეკულური ურთიერთქმედების უგულებელყოფის მიზნით, გარდა შეჯახებისა; მოლეკულები განიცდიან არაელასტიკურ შეჯახებებს.
დ) ძალიან დიდი საშუალო მანძილი მოლეკულებს შორის და ძლიერი ინტერმოლეკულური ურთიერთქმედება; მოლეკულები ელასტიურ შეჯახებებს განიცდიან.
რეზოლუცია:
გაზის იდეალურ მოდელში განზომილებიანი ნაწილაკების დიდი რაოდენობა დიდი სიჩქარით მოძრაობს შემთხვევითი მიმართულებით. ერთადერთი ურთიერთქმედება, რომელსაც ამ ნაწილაკები განიცდიან, არის სრულყოფილად ელასტიური შეჯახებები, ამიტომ სწორი ალტერნატივაა ასო ა.
კითხვა 2 - (UFRGS) განვიხილოთ შემდეგი განცხადებები იდეალური გაზების შესახებ.
ᲛᲔ. PV = nRT გაზების მდგომარეობის განტოლებაში არსებული მუდმივი R აქვს იგივე მნიშვნელობა ყველა იდეალური აირისთვის.
II სხვადასხვა იდეალური გაზების თანაბარი მოცულობები, იმავე ტემპერატურასა და წნევაზე, შეიცავს იგივე რაოდენობის მოლეკულას.
III იდეალური გაზის მოლეკულების საშუალო კინეტიკური ენერგია პირდაპირპროპორციულია გაზის აბსოლუტური ტემპერატურისა.
რომელია სწორი?
ა) მხოლოდ მე
ბ) მხოლოდ II
გ) მხოლოდ III
დ) მხოლოდ I და II
ე) I, II და III
შაბლონი:
მოდით ვნახოთ ალტერნატივები:
ᲛᲔ. სწორია, ამიტომ მას იდეალური აირების უნივერსალურ მუდმივას უწოდებენ.
II სწორია. კლაპეირონის განტოლების თანახმად, თუ ორ იდეალურ გაზს აქვს იგივე წნევა, ტემპერატურა და მოცულობა, მაშინ ამ გაზებში ნაწილაკების რაოდენობა ტოლია.
III სწორია. ენერგიის განყოფილების თეორემის თანახმად, იდეალურ გაზში ნაწილაკების კინეტიკური ენერგია მისი ტემპერატურის პროპორციულია.
ამიტომ, სწორი ალტერნატივაა ასო ე.
კითხვა 3 - (UFJF) მამაკაცებმა, როგორიცაა Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls და სხვ., შეიმუშავეს მნიშვნელოვანი კვლევები გაზების თვისებების შესახებ. რეალური გაზების ქცევა უახლოვდება იდეალურ გაზებს დაბალი წნევის პირობებში, აგრეთვე გაზებს, რომლებიც შეიცავს დიდ მოცულობას და მაღალ ტემპერატურაზე დაცულ გაზებს. გაითვალისწინეთ, რომ ლაბორატორიულ ექსპერიმენტში V მოცულობის კონტეინერი მთლიანად დახურულია და შეიცავს 1 მოლ იდეალურ გაზს 4.0 წნევის ქვეშ. ატმოსფერო ექვემდებარება გაფართოებას მუდმივ ტემპერატურაზე, ტოლი 127 º C და რომ ამ გაზის ქცევა არის იდეალური გაზი, როგორც ეს ნაჩვენებია გრაფიკული
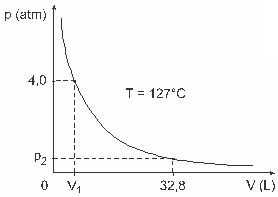
ამ შემთხვევაში, როდესაც გაზი იკავებს 32.8 ლ ტოლ მოცულობას, მის მიერ განხორციელებული ზეწოლა იქნება:
(მოცემულია: სრულყოფილი აირების უნივერსალური მუდმივაა R = 0,082 ატმოსფერო. ლ / მოლი. კ.)
ა) 0,32 ატმოსფერო
ბ) 0,40 ატმოსფერო
გ) 1.0 ატმოსფერო
დ) 2.0 ატმოსფერო
ე) 2.6 ატმოსფერო
რეზოლუცია:
წერილი C.
სავარჯიშოს გადასაჭრელად, ჩვენ უნდა გამოვიყენოთ მონაცემები კლაპეირონის განტოლებას, მაგრამ მანამდე უნდა გადავიყვანოთ ტემპერატურა, რომელიც ცელსიუსის გრადუსებშია, კელვინზე. შეამოწმეთ:

რაფაელ ჰელერბოკის მიერ
ფიზიკის მასწავლებელი