კოვალენტური კავშირი ხდება მაშინ, როდესაც ორი ატომი ელექტრონულ წყვილებს ანაწილებს ელექტრონის ელექტრონული კონფიგურაციის მისაღებად კეთილშობილი გაზი (8 ელექტრონით ვალენტურ გარსში ან 2-ით, მხოლოდ K გარსის მქონე პირთა შემთხვევაში), წესის შესაბამისად ოქტეტი.
ამასთან, არსებობს კოვალენტური ობლიგაციების განსაკუთრებული შემთხვევები, რომლებშიც საერთო ელექტრონული წყვილი მოდის მხოლოდ ერთი ატომიდან, რომელიც უკვე სტაბილურია. ადრე ამ ტიპის კოვალენტურ ბმას უწოდებდნენ დატიური, დღეს მას უფრო ხშირად უწოდებენ კოორდინაცია.
იხილეთ რამდენიმე მაგალითი, რომ გაიგოთ, როგორ ხდება ეს:
- CO (ნახშირბადის მონოქსიდი):
ნახშირბადს აქვს 4 ელექტრონი თავის ვალენტურ გარსში. ამიტომ, ოქტეტის წესის თანახმად, სტაბილური რომ იყოს, მას კიდევ 4 ელექტრონის მიღება სჭირდება, ჯამში 8. ჟანგბადს, 6 ელექტრონი აქვს ვალენტურ გარსში და საჭიროა 2 ელექტრონის მიღება, რათა კეთილშობილი გაზის ნეონის კონფიგურაცია შეინარჩუნოს.
ასე რომ, პირველ რიგში, ნახშირბადს და ჟანგბადს ორი წყვილი ელექტრონი აქვთ, რომ ჟანგბადი სტაბილური იყოს:
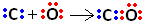
ამასთან, ნახშირბადი არასტაბილური რჩება, რადგან მას ჯერ კიდევ აქვს 6 ელექტრონი და სჭირდება 2. ამიტომ, ჟანგბადი, რომელიც უკვე სტაბილურია, თავის ელექტრონულ ერთ-ერთ წყვილს ნახშირბადს უზიარებს, ანუ ქმნის მას დათიურ ბმას, რაც მას სტაბილურს ხდის:

გაითვალისწინეთ, რომ კოორდინატთა კოვალენტური ბმა შეიძლება წარმოდგენილი იყოს ტირეთი, ისევე როგორც საერთო კოვალენტური ობლიგაცია.
- მხოლოდ2 (გოგირდის დიოქსიდი):
გოგირდისა და ჟანგბადის თითოეულ ატომს აქვს 6 ელექტრონი ვალენტურ გარსებში, ამიტომ მათ უნდა მიიღონ თითოეულის 2 ელექტრონი. თავდაპირველად, გოგირდი ქმნის ორ საერთო კოვალენტურ კავშირს, ჟანგბადის ერთ ატომს ანაწილებს ორი წყვილი ელექტრონი, ორივე რჩება სტაბილურად 8 ელექტრონთან.
ნუ გაჩერდები ახლა... რეკლამის შემდეგ მეტია;)
ჟანგბადის სხვა ატომი არ არის სტაბილური, ამიტომ გოგირდის კოორდინირებული ან დატორული კოვალენტური კავშირის საშუალებით მას ეზიარება წყვილი მისი ელექტრონები:
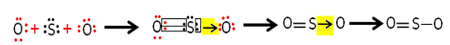
გაითვალისწინეთ, რომ ამ შემთხვევაში მოლეკულაში გვაქვს სამი ატომი, ამიტომ შეიძლება მოხდეს ბმის მიგრაცია ერთი ატომიდან მეორეზე. გოგირდის დიოქსიდის მოლეკულაც შეიძლება ასე იყოს წარმოდგენილი: O ─ S ═ O.
ჩვენ ამ შემაკავშირებელ ფენომენს ვუწოდებთ რეზონანსი. იხილეთ კიდევ სამი მაგალითი ქვემოთ მოცემულ ცხრილში:
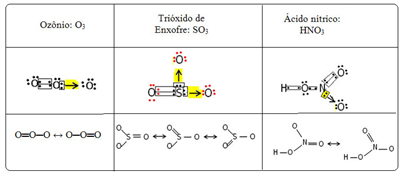
შესაძლო სტრუქტურებს უწოდებენ რეზონანსული სტრუქტურები ან კანონიკური ფორმები.
ამ ტიპის კავშირი ასევე ხდება იონების წარმოქმნისას, როგორც ჰიდრონიუმის იონების შემთხვევაში (H3ო+) და ამონიუმი (NH4+).
პირველი, H კათიონი+ ის წარმოიქმნება, როდესაც წყალბადის დაკარგავს ერთ ელექტრონს, რის შედეგადაც მას დადებითი მუხტი აქვს. ასე რომ, სტაბილურობისთვის საჭიროა ორი ელექტრონის მიღება. ეს ხდება წყლით (წყალბადის იონის შემთხვევაში) და ამიაკით (ამონიუმის იონის შემთხვევაში) დადატიული კავშირის საშუალებით. Უყურებს:

ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
გსურთ მიუთითოთ ეს ტექსტი სასკოლო ან აკადემიურ ნაშრომში? შეხედე:
FOGAÇA, ჯენიფერ როშა ვარგასი. "დატიური ან კოორდინირებული კოვალენტური კავშირი"; ბრაზილიის სკოლა. Ხელმისაწვდომია: https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm. წვდომა 2021 წლის 28 ივნისს.


