ვალენტობის ფენა ეს არის ატომის ყველაზე შორეული შრე (ან დონე) (ბირთვიდან შორს), ანუ ბირთვიდან ყველაზე შორეული. აქედან გამომდინარე, მას აქვს ე.წ. ყველაზე შორეული ელექტრონები ან ვალენტური ელექტრონები.
ატომის დონის რაოდენობა შეიძლება იცვლებოდეს 1-დან 7-მდე, რომელსაც აქვს შემდეგი ქვედონეები (ყვითლად):
დონე K (1 ფენა): ქვესკნელი ს
დონე L (მე -2 ფენა): ქვედონეები ს და პ
დონე M (მე -3 ფენა): ქვედონეები ს, პ და დ
დონე N (მე -4 ფენა): ქვედონეები ს, პ, დ და ვ
დონე O (მე -5 ფენა): ქვედონეები ს, პ, დ და ვ
P დონე (მე -6 იარუსი): ქვედონეები ს, პ და დ
დონე Q (1 ფენა): ქვედონეები ს და პ
თითოეულ ქვედენაზე მოცემულია ელექტრონების სხვადასხვა რაოდენობა. შეხედე:
ქვექვემდებარების s ფლობს მაქსიმუმ 2 ელექტრონს;
ქვესკნელი p ფლობს მაქსიმუმ 6 ელექტრონს;
ქვედენა დ ფლობს მაქსიმუმ 10 ელექტრონს;
ქვედენა f მაქსიმუმ 14 ელექტრონს ფლობს.
ამრიგად, თუ გარკვეული ატომის ვალენტური გარსია M, ელექტრონების მაქსიმალური რაოდენობა, რომელთაც შეუძლიათ მასში იმყოფება 18 (2 ელექტრონი ქვესკნელიდან + 6 ელექტრონი ქვესკვრიდან + 10 ელექტრონი ქვედონე დ)
ატომის ვალენტური გარსის დასადგენად და რამდენი ელექტრონი აქვს მას, არსებობს ორი გზა, კერძოდ:
→ ვალენტური გარსის და მისი ელექტრონების რაოდენობის განსაზღვრა ელექტრონული განაწილებიდან
ელექტრონული განაწილება ყოველთვის ხორციელდება ლინუს პაულინგის დიაგრამაწარმოდგენილია ქვემოთ:

ლინუს პაულინგის სქემის წარმოდგენა
ჩვეულებრივი ატომური რიცხვი (რაც მიუთითებს ელექტრონების რაოდენობაზე ატომში), ჩვენ ვაკეთებთ ელექტრონულ განაწილებას. მაგალითად, 50 ატომური ატომი:

ატომური რიცხვის ატომის ელექტრონული განაწილება ტოლია 50-ის
ზემოთ მოყვანილი განაწილების ანალიზით, ჩვენ გვაქვს ის, რომ ბირთვიდან ყველაზე შორეული დონეა მე -5 (N დონე), რომელშიც ჩვენ გვაქვს 4 ელექტრონის არსებობა (ორი s ქვედენაში და 2 p ქვედენაში).
The პერიოდული ცხრილიდან ვალენტური გარსის და მისი ელექტრონების რაოდენობის განსაზღვრა
ცხრილი განლაგებულია პერიოდებად (ჰორიზონტალური სვეტები), რომლებიც მიუთითებენ ატომის დონეთა რაოდენობაზე და ჯგუფებზე ან ოჯახებზე (ვერტიკალური სვეტები). პერიოდს იყენებენ ვალენტობის ფენადა ოჯახებს იყენებენ ელექტრონების რაოდენობის დასადგენად.
ა) ქიმიური ელემენტის პერიოდის ცოდნა
პერიოდულ ცხრილში მოცემულია სულ შვიდი პერიოდი, რომელთა რიცხვი დაკავშირებულია ლინუს პაულინგის დიაგრამაში არსებული დონის რაოდენობასთან. ასე რომ, თუ ვიცით ის პერიოდი, რომელშიც ქიმიური ელემენტი ის ავტომატურად გვხვდება ცხრილში, ჩვენ ვიცით, რამდენი დონე აქვს თქვენს ატომებს, ვალენტობის ფენა ბირთვიდან ყველაზე შორს მდებარე დონეზეა.
პირველი მაგალითი: ქიმიური ელემენტი კალიუმი
კალიუმი განლაგებულია პერიოდული ცხრილის მეოთხე პერიოდში, ამიტომ მის ატომს ოთხი აქვს დონეები, მეოთხე დონეა ვალენტობის ფენა, რაც დასტურდება მისი განაწილებით ელექტრონიკა.
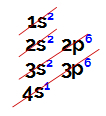
კალიუმის ელემენტის ელექტრონული განაწილება
მე -2 მაგალითი: ქიმიური ელემენტი ფტორი
ფტორი განლაგებულია პერიოდული ცხრილის მეორე პერიოდში, ამიტომ მის ატომს ორი აქვს დონეები, მეორე დონეა ვალენტობის ფენა, რაც დასტურდება მისი განაწილებით ელექტრონიკა.

ფტორის ელემენტის ელექტრონული განაწილება
მე -3 მაგალითი: ინდიუმის ქიმიური ელემენტი
ინდოელი განლაგებულია პერიოდული სისტემის მეხუთე პერიოდში, ამიტომ მის ატომს ხუთი აქვს დონეები, მეხუთე დონეა ვალენტობის ფენა, რაც დასტურდება მისი განაწილებით ელექტრონიკა.

ინდუმის ელემენტის ელექტრონული განაწილება
ბ) ქიმიური ელემენტის ოჯახის ან ჯგუფის ცოდნა
ვიცით ოჯახი ან ჯგუფი, რომელშიც ელემენტია განლაგებული, ჩვენ ასევე ვიცით იმ ელექტრონების რაოდენობა, რომლებიც იმყოფება ამ ელემენტის ვალენტურ გარსში.
ოჯახის ელემენტები ა
A ოჯახების ელემენტები განლაგებულია პერიოდული ცხრილის 1, 2, 13-დან 18 სვეტებში. თითოეული ეს სვეტი იღებს რიცხვს (1-დან 8-მდე, რომაული რიცხვი), რომელიც ზუსტად მიუთითებს ელექტრონების რაოდენობაზე ამ ელემენტების ვალენტურ გარსში:
სვეტი 1 - IA ოჯახი = ყველას აქვს 1 ელექტრონი ვალენტობის გარსში;
სვეტი 2 - IIA ოჯახი = ყველას აქვს 2 ელექტრონი ვალენტობის გარსში;
სვეტი 3 - IIIA ოჯახი = ყველას აქვს 3 ელექტრონი ვალენტობის გარსში;
სვეტი 4 - IVA ოჯახი = ყველას აქვს 4 ელექტრონი ვალენტობის გარსში;
სვეტი 5 - VA ოჯახი = ყველას აქვს 5 ელექტრონი ვალენტობის გარსში;
სვეტი 6 - VIA ოჯახი = ყველას აქვს 6 ელექტრონი ვალენტობის გარსში;
სვეტი 7 - VIIA ოჯახი = ყველას აქვს 7 ელექტრონი ვალენტობის გარსში;
სვეტი 8 - ოჯახი VIIIA = ყველას აქვს 8 ელექტრონი ვალენტობის გარსში.
იხილეთ ოჯახის ზოგიერთი ელემენტის ვალენტური ელექტრონების რაოდენობის განსაზღვრის რამდენიმე მაგალითი:
მაგალითი 1: ბარიუმის ქიმიური ელემენტი
ბარიუმი მდებარეობს IIA ოჯახში, ამიტომ მას აქვს ორი ელექტრონი ვალენტურ გარსში, რაც დასტურდება მისი ელექტრონული განაწილებით:

ბარიუმის ელემენტის ელექტრონული განაწილება
მაგალითი 2: სტიბიუმის ქიმიური ელემენტი
სტიბიუმი მდებარეობს VA ოჯახში, ამიტომ მას აქვს ხუთი ელექტრონი ვალენტურ გარსში, რაც დასტურდება მისი ელექტრონული განაწილებით:

სტიბიუმის ელემენტის ელექტრონული განაწილება
მაგალითი 3: ქსენონის ქიმიური ელემენტი
ქსენონი მდებარეობს VIIIA ოჯახში, ამიტომ მას აქვს რვა ელექტრონი ვალენტურ გარსში, რასაც ადასტურებს მისი ელექტრონული განაწილება.

ქსენონის ელემენტის ელექტრონული განაწილება
შენიშვნა: ერთადერთი ქიმიური ელემენტი, რომელიც მიეკუთვნება A ოჯახს, რომელიც არ შეესაბამება შემოთავაზებულ წესს არის ჰელიუმი. იგი VIIIA ოჯახს მიეკუთვნება, მაგრამ ვალენტურ გარსში მხოლოდ ორი ელექტრონია. ეს იმიტომ ხდება, რომ მისი ატომური ნომერია 2, ამიტომ შეუძლებელია მას ჰქონდეს 8 ელექტრონი ვალენტური გარსით, ისევე როგორც ოჯახის სხვა ელემენტები.
ჰელიუმის ატომის ელექტრონული განაწილება
ოჯახის B ელემენტები
B ოჯახების ელემენტები განლაგებულია პერიოდული ცხრილის მე -3 და მე -12 სვეტებში. ისევე როგორც A ოჯახები, ასევე არსებობს რვა B ოჯახი, რომლებიც წარმოდგენილია რომაული ციფრებით. A ოჯახებისგან განსხვავებით, B ოჯახის რაოდენობა არ განსაზღვრავს ელექტრონების რაოდენობას ვალენტურ გარსში.
ელექტრონული ჯგუფის ოჯახის ელემენტის ვალენტური გარსის ელექტრონების რაოდენობა ყოველთვის უდრის 2-ს, განურჩევლად ატომური რიცხვისა და ცხრილის პოზიციისა. კალიფორნიუმის ელექტრონული განაწილება (98შდრ) და ჰასიუსი (108თ.ს) ამის დამტკიცება:
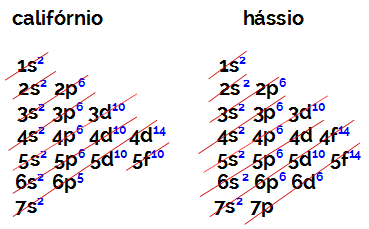
კალიფორნიუმის ელექტრონულ განაწილებას აქვს ყველაზე ენერგიული ქვესკნელი 5f10, და ჰასსიუსის o არის 6d6. ორივე შემთხვევაში, ბირთვიდან ყველაზე შორს მდებარე ქვესკნელი მეშვიდე დონეა და ორივეს ორი განაწილებული ელექტრონი აქვს.
ჩემ მიერ. დიოგო ლოპეს დიასი
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-camada-valencia.htm


