დალტონის კანონში ნათქვამია, რომ გაზის ნარევში თითოეული გაზის ნაწილობრივი წნევა ტოლია წნევისა, რომელსაც ის ახდენს ნარევის მოცულობის დასაკავებლად, იმავე ტემპერატურაზე. ამიტომ, გაზის ნარევის მთლიანი წნევა არის თითოეული აირის ნაწილობრივი წნევის ჯამი, რომელიც მას ქმნის.
განვიხილოთ ორი ტიპის გაზები, A და B. თითოეულ მათგანს იკავებს იგივე მოცულობის V და აქვს იგივე ტემპერატურა T. თუ კლაპეირონის განტოლებას მივმართავთ A და B ორ გაზზე, გვაქვს:
პ .V = n .R .T და pბ .V = nბ .რ .ტ
როგორც ეს ზემოთ ნაჩვენებ სურათზეა ნაჩვენები, თუ ჩვენ აირს ავურევთ ორ გაზს, გაზების მოლების რაოდენობა ნარევში (არამ) ხდება:
არამ= n+ ნბ
სად:
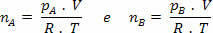
მაგრამ nm = (Pm.V) / რ. T; ასე რომ, ჩვენ გვაქვს:
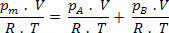
გამარტივების გაკეთება ზემოთ გამოხატულებაში, ჩვენ გვაქვს:
პმ= გვ+ გვბ (დალტონის კანონი)
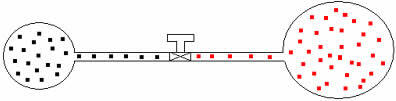
ჩვენ შეგვიძლია იგივე მსჯელობა გამოვიყენოთ სხვადასხვა მოცულობის და ტემპერატურის გაზებზე. მოდით ვნახოთ ქვემოთ მოცემული ფიგურა, რომელშიც ორი ბუშტი, რომელსაც შეუსაბამო მოცულობის მილი უკავშირდება, აქვს საკონტაქტო ონკანი. ამ ბუშტებს აქვთ ორი A და B გაზები, რომელთა ტემპერატურა და მოცულობა განსხვავდება ერთმანეთისგან. ნახაზიდან ვხედავთ, რომ ონკანი დახურულია, ამიტომ:
პ .V = n .R .T და pბ .V = nბ .რ .ტ
მოგვიანებით, თუ ონკანს გავხსნით, დავინახავთ, რომ გაზები ერთმანეთში ერევა, როგორც ეს ნაჩვენებია ქვემოთ მოცემულ ილუსტრაციაზე:
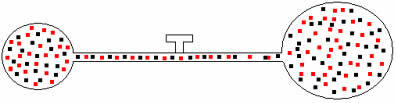
ამ ნარევისთვის ჩვენ გვაქვს შემდეგი ურთიერთობები:
ვმ= V+ Vბ
პ .V = n .რ .ტ
პბ .V = nბ .რ .ტ
ასე რომ, ჩვენ გვაქვს, რომ ამ ნარევის საბოლოო ურთიერთობა შეიძლება გავრცელდეს ნარევის ნარევზე არა გაზები. ამრიგად:
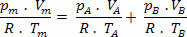
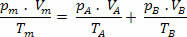
დომიტიანო მარკესის მიერ
დაამთავრა ფიზიკა
ბრაზილიის სკოლის გუნდი