ტექსტში "სათაური ან მასობრივი პროცენტი”ჩვენ ვნახეთ როგორ გამოვთვალოთ თანაფარდობა ხსნადი მასისა და ხსნარის მასას შორის მყარი, თხევადი და აირისებრი ხსნარებისათვის. ამასთან, ამ ტექსტში ვნახავთ, რომ ასევე შესაძლებელია ტიტრის გამოთვლა მოცულობის თვალსაზრისით, თხევადი ან გაზური კომპონენტებით ხსნარებისათვის.

მოცულობის სათაური შეიძლება გამოითვალოს გამოთქმით:
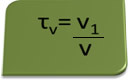
მაგალითად განვიხილოთ ეთილის სპირტის წყალხსნარი, რომელიც გამოიყენება როგორც ანტისეპტიკური და სადეზინფექციო საშუალება, მომზადებულია 70 მლ სუფთა სპირტის დამატებით წყალში, რათა შეადგინოს 100 მლ მოცულობის მოცულობა გამოსავალი ასე რომ, ჩვენ გვაქვს:
τ = 70 მლ = 0,7
100 მლ
შეგვიძლია სათაური პროცენტულად გამოვხატოთ, უბრალოდ გავამრავლოთ შედეგი 100% -ზე. ამ შემთხვევაში, ჩვენ გვაქვს 70% ეთილის სპირტის ხსნარი, რაც ნიშნავს, რომ ხსნარის ყოველი 100 მოცულობითი ერთეულიდან, 70 მოცულობის ერთეული არის ალკოჰოლი.
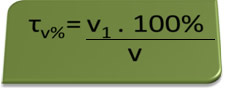
ქვემოთ მოცემულ შემთხვევაში, ჩვენ გვაქვს 70% ეთილის სპირტის ხსნარი 250 მლ მოცულობის ხსნარში; რაც ნიშნავს, რომ 175 მლ არის ალკოჰოლი, გამოთვლების მიხედვით:
100 მლ 70 მლ ალკოჰოლი
250 მლ x
x = 70. 250
100
X = 175 მლ ალკოჰოლი

ამასთან, ვერ ვიტყვით, რომ ამ შემთხვევაში გვაქვს 75 მლ (250-175) წყალი. მასის ტიტრისგან განსხვავებით, რომელშიც შეგვიძლია გამხსნელის მასა დავუმატოთ გამხსნელ მასას, რომ ვიპოვოთ ხსნარის მასა, ეს არ შეიძლება გაკეთდეს მოცულობის ტიტრთან მიმართებაში.

ნუ გაჩერდები ახლა... რეკლამის შემდეგ მეტია;)
ეს ნიშნავს, რომ ხსნარის მოცულობა არ არის ტოლი გამხსნელის მოცულობისა და ხსნადი მოცულობის ჯამის (თუმცა ხშირად განსხვავება შეიძლება ჩაითვალოს უმნიშვნელოდ). ეს იმიტომ ხდება, რომ ამ სითხეებში არსებული ინტერმოლეკულური ძალები გავლენას ახდენენ საბოლოო მოცულობაზე.
ხსენებული ხსნარის შემთხვევაში, ეთილის სპირტი, მაგალითად, როდესაც ჩვენ ალკოჰოლს ვურევთ წყალს, ხდება ხსნარის მთლიანი მოცულობის შეკუმშვა; ანუ საბოლოო მოცულობა უფრო მცირე იქნება ვიდრე მხოლოდ ალკოჰოლისა და წყლის მოცულობის დამატება. ეს იმიტომ ხდება, რომ ალკოჰოლის მოლეკულები ამყარებენ კავშირებს ან წყალბადის კავშირებს წყლის მოლეკულებთან, ამცირებენ მათ შორის არსებულ ადგილებს.
ამიტომ, ამ და სხვა შემთხვევებში, ხსნარის მოცულობა უნდა გაიზომოს ექსპერიმენტულად, როდესაც არ არის გათვალისწინებული სავარჯიშოში.
მოცულობის პროცენტული მაჩვენებელი ფართოდ გამოიყენება ალკოჰოლური სასმელების და კომერციული ალკოჰოლის შემთხვევებში, როგორც ზემოთ აღინიშნა. იხილეთ ამ გაანგარიშების ორი მნიშვნელოვანი პროგრამა:
- სუნთქვა: სუნთქვა ზომავს ეთილის სპირტის კონცენტრაციას სისხლში და ბრაზილიაში აკრძალულია ვინმეს მართოს ნებისმიერი ტიპის მანქანა, რომლის სისხლში ალკოჰოლის შემცველობა ტოლია ან აღემატება 0,1% მოცულობას. ამ ალკოჰოლის შემცველ ადამიანს აქვს თითოეული ლიტრი სისხლისთვის 1 მლ ალკოჰოლი, როგორც ეს ნაჩვენებია შემდეგი გათვლებით:
τv%=ვ1. 100%
ვ
0,1 % = ვ1. 100%
1 ლ
ვ1 = 0,1% V1 = 0.001 ლ = 1 მლ
100%

- ეთანოლის შემცველობა ბენზინში: ბრაზილიაში ბენზინი რეგულირდება ეთანოლის დამატებით. მაგრამ ბენზინში ეთანოლის შემცველობა უნდა იყოს მაქსიმუმ 24% უწყლო სპირტის მოცულობით (ვინაიდან ბენზინი არ უნდა იყოს წყალი). რაც უფრო მეტ ეთანოლს ემატება ბენზინი, მით უფრო მსუბუქდება საწვავის ფერი და იზრდება მისი სიმკვრივე.
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
გსურთ მიუთითოთ ეს ტექსტი სასკოლო ან აკადემიურ ნაშრომში? შეხედე:
FOGAÇA, ჯენიფერ როშა ვარგასი. "ქიმიური ხსნარის მოცულობის სათაური"; ბრაზილიის სკოლა. Ხელმისაწვდომია: https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm. წვდომა 2021 წლის 28 ივნისს.
Ქიმია

როგორ მუშაობს სუნთქვა, ალკოჰოლის კონცენტრაცია, სუნთქვა, რეაქციები ეთილის ალკოჰოლზე, ტიპები სუნთქვის გამაფართოებლები, კალიუმის დიქრომატი, საწვავის უჯრედი, კატალიზატორი, ელექტრონის გამოყოფა, ძმარმჟავა, წყალბადის, კორპუსი



