როდესაც ჩვენ სხვადასხვა ელემენტებს ვაძლევთ ალის მოქმედებას, ვამჩნევთ, რომ თითოეული მათგანი განსხვავებულ ფერს გამოსცემს. მაგალითად, თუ სტრონციუმს, ნატრიუმს და სპილენძის მარილს დავწვავთ, შესაბამისად ვნახავთ წითელ, მწვავე ყვითელ და მწვანეს ფერებს, როგორც ნაჩვენებია შემდეგ სურათზე:

თუ ამ ალების შუქი პრიზმაზე მოდის, a წყვეტილი სპექტრი, ანუ, მხოლოდ რამდენიმე ფერადი ნათელი ხაზი იქნება დაფიქსირებული რეგიონებში, რომლებიც სინათლის გარეშე მდებარეობს. თითოეული ელემენტისთვის ჩვენ განსხვავებული სპექტრი გვექნება.

ამ ტიპის სპექტრებს უწოდებენ ემისიის სპექტრი, რადგან ისინი გაცემულია გარკვეული ელემენტის მიერ და ემსახურება მის იდენტიფიკაციას.
მსგავსი სპექტრის მიღება შესაძლებელია მაღალ ელექტრულ გამდინარე მილში წარმოქმნილი სინათლის სხივის საშუალებით ტემპერატურა და დაბალი წნევა, შეიცავს გაზებს გარკვეული ელემენტებისგან, მაგალითად, წყალბადისგან, ან კეთილშობილი გაზებისგან ქვემოთ:

პრიზმაში წარმოებული ამ ელექტრომაგნიტური გამოსხივების (სინათლის) გავლით მიიღება თითოეული ამ ელემენტის ემისიის სპექტრი.
ადრე ფიქრობდნენ, რომ მზის სპექტრი მიღწეული იყო სრულიად უწყვეტი, მაგრამ ინგლისელმა მეცნიერმა უილიამ ჰაიდ ვოლასტონმა დაადგინა, რომ სინათლის ძალიან ვიწრო სხივთან მუშაობით, დაახლოებით 0,01 მმ ჭრილით, ხედავდით, რომ მზის სპექტრი შეიცავს შვიდ შავ ხაზს ამის შესახებ. მოგვიანებით, ახალგაზრდა
ჯოზეფ ფრაუნჰოფერი (1787-1826), პრიზმებისა და დიფრაქციული ქსელების გამოყენებით, დაადგინა, რომ მზის სპექტრი სინამდვილეში შეიცავს ათასობით ზედ დაყენებულ შავ ხაზს.რამდენიმე ხნის შემდეგ ფიზიკური გუსტავ რობერტ კირხოფი მან შენიშნა, რომ ნატრიუმის სპექტრის მიერ მიღწეული ყვითელი ლაქები ზუსტად იმავე ადგილას იყო, როგორც მზის სპექტრის ორი შავი ხაზი. ის და ქიმიკოსი რობერტ ვილჰელმ ბუნსენი ჩაატარა რამდენიმე ექსპერიმენტი და შეამჩნია, რომ თუ ბუნზენის სანთურის თეთრი შუქი, მაგალითად მზის შუქი, გაივლის ნატრიუმის მიერ გამოყოფილ ყვითელ შუქთან და პრიზმა გადაიკვეთა სპექტრის წარმოსაქმნელად; შედეგი იქნება უწყვეტი მზის სპექტრი, ცისარტყელას ფერებში, მაგრამ შავი ხაზებით (ფრაუნჰოფერის მიერ D ხაზებს ეწოდება) იმავე მდგომარეობაში, როგორც ნატრიუმის სპექტრის ყვითელი ხაზები.
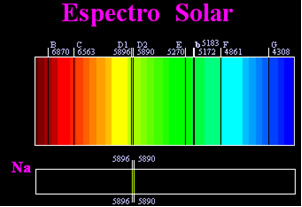
მზე ასხივებს ყველა ფერის სინათლეს, წითელიდან იისფერამდე, თუმცა დედამიწის ატმოსფეროში გავლისას არსებული გაზები მზის სინათლეს შთანთქავს ზუსტად მათ მიერ გამოცემულ ფერებში.
ამ ტიპის სპექტრებს უწოდებენ შთანთქმის სპექტრები.
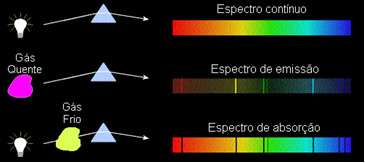
ამ დაკვირვების საფუძველზე, კირხოფი შექმნა სამი კანონები სპექტროსკოპიისთვის, რომლებიც:
1) სხეული გაუმჭვირვალე ცხელი, სამი ფიზიკური მდგომარეობიდან რომელიმე, ასხივებს სპექტრს უწყვეტი.
2) გაზი გამჭვირვალე - ისეთი კეთილშობილი აირების მსგავსად, რომლებიც ზემოთ ვნახეთ - აწარმოებს ა ემისიის სპექტრი, გამოჩენა ხაზები ნათელი ამ ხაზების რაოდენობა და პოზიცია განისაზღვრება გაზში არსებული ქიმიური ელემენტებით.
3) თუ ა უწყვეტი სპექტრი გაზიდან გადის ყველაზე დაბალ ტემპერატურაზე, ცივი გაზი იწვევს არსებობას მუქი ხაზები, ეს არის შთანთქმის სპექტრი. ეს არის ის, რაც დაემართა მზის შუქის სპექტრს ნატრიუმის გაზში. ამ შემთხვევაში, შთანთქმის სპექტრში ხაზების რაოდენობა და პოზიცია ასევე დამოკიდებულია გაზში არსებულ ქიმიურ ელემენტებზე.
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm

