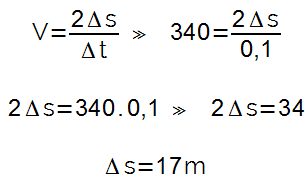კლაპეირონის განტოლება არის ფრანგი ფიზიკოსი-ქიმიკოსისა და სამოქალაქო ინჟინრის ბენუა-პიერ-ემილე კლაპეირონის მიერ შემოთავაზებული მათემატიკური გამონათქვამი და ჩამოყალიბებულია შესანიშნავი გაზი. გაითვალისწინეთ შემდეგი განტოლება:
P.V = n. RT
P = წნევა, რომელსაც წარმოქმნის გაზი კონტეინერის კედლებზე;
V = გაზით დაკავებული მოცულობა და მისი გამოხატვა შესაძლებელია ლიტრებში ან კუბურ მეტრებში;
n = რიცხვი მოლი (გაზის მატერიის რაოდენობა);
Შენიშვნა: მოლების რაოდენობა გამოიხატება აირის მასასა (მ) და მას შორის დამოკიდებულებით მოლური მასა (M):
n = მ
მ
R = კლაპეირონის მიერ შემოთავაზებული გაზის ზოგადი მუდმივა და დამოკიდებულია გამოყენებულ წნევის ერთეულზე (ატმოსფეროში ეს არის 0,082; mmHg– ით 62,3; KPa– ში, ეს არის 8.31);
T = ტემპერატურა, რომელზეც გაზი ექვემდებარება (ყოველთვის გამოიყენება კელვინის განყოფილებაში).
Შენიშვნა: მოცემული ტემპერატურის ცელსიუსის გრადუსებად გარდაქმნა კელვინიდან, უბრალოდ დაამატეთ მისი მნიშვნელობა 273-ზე.
ამრიგად, გამოყენებით კლაპეირონის განტოლება, ჩვენ შეგვიძლია განვსაზღვროთ რამდენიმე ცვლადი, რომელიც ეხება გაზს, როგორც ხედავთ ქვემოთ მოცემულ თითოეულ მაგალითში:
პირველი მაგალითი: (Uefs-BA) 24.6 ლ ჭურჭელში შეიცავს 1.0 მოლი აზოტი, რომელიც ახდენს 1.5 ატმოსფერულ წნევას. ამ პირობებში, კელვინის მასშტაბით გაზის ტემპერატურაა:
ა) 30 ბ) 40 გ) 45 დ) 300 ე) 450
T =?
n = 1 მოლი
R = 0,082 ატმოსფერო. ლ / მოლი. K (რადგან წნევა არის ატმოსფეროში)
მოცულობა = 24,6 ლ
P = 1.5 ატმოსფერო
მოცემულ მონაცემებში შეყვანა კლაპეირონის განტოლება, ჩვენ შეგვიძლია დავადგინოთ საჭირო ტემპერატურა:
P.V = n. RT
1.5,24.6 = 1.0.082.T
36,9 = 0,082 ტ
36,9 = თ
0,082
T = 450 კ
მე -2 მაგალითი: (Unimep-SP) 25 ºC და 1 ატმოსფეროში გახსენით 0,7 ლიტრი ნახშირორჟანგი ერთ ლიტრ გამოხდილ წყალში. CO– ს ეს რაოდენობა2 დგას:
(მონაცემები: R = 0,082 ატმ.ლ / მოლ.კ; ატომური მასები: C = 12; 0 = 16).
ა) 2,40 გ
ბ) 14,64 გ
გ) 5,44 გ
დ) 0,126 გ
ე) 1,26 გ
T = 25 ° C, რაც 273 შედეგს დაემატა 298 K
მ =?
R = 0,082 ატმოსფერო. ლ / მოლი. K (რადგან წნევა არის ატმოსფეროში)
მოცულობა = 0,7 ლ
P = 1 ატმოსფერო
მოცემულ მონაცემებში შეყვანა კლაპეირონის განტოლება, ჩვენ შეგვიძლია დავადგინოთ საჭირო მასა:
P.V = n. RT
1.0,7 = მ .0,082.298
44
0,7 = მ .24,436
44
0.7.44 = მ .24.436
30.8 = მ .24.436
30,8 = მ
24,436
მ = 1,26 გ (დაახლოებით)
მე -3 მაგალითი: (Fesp-PE) 75-მდე ოC და 639 mmHg, 1,065 გ ნივთიერებას იკავებს 623 მლ აირულ მდგომარეობაში. ნივთიერების მოლეკულური მასა ტოლია:
ა) 58 ბ) 0,058 გ) 12,5 დ) 18,36 ე) 0,0125
T = 75 ° C, რაც 273 შედეგს დაემატა 348 K
მ = 1,065 გ
R = 62,3 მმ.ვწყ.სვ. ლ / მოლი. K (რადგან წნევა არის mmHg)
მოცულობა = 623 მლ, რომელიც გაყოფილია 1000 შედეგზე 0.623 ლ
P = 639 mmHg
M =?
მოცემულ მონაცემებში შეყვანა კლაპეირონის განტოლება, ჩვენ შეგვიძლია დავადგინოთ საჭირო მოლეკულური მასა:
P.V = n. RT
PV = მ .რტ
მ
639.0,623 = 1,065.62,3.348
მ
398,097 = 23089,626
მ
ნუ გაჩერდები ახლა... რეკლამის შემდეგ მეტია;)
398.097 მ = 23089.626
M = 23089,626
398,097
M = 58 u
მე -4 მაგალითი: (UFRJ) აუცილებელია გარკვეული რაოდენობის აირული ჟანგბადის შენახვა2). გაზის მასა არის 19,2 გ 277 ტემპერატურაზე ოC და 1.50 ატმოსფეროს წნევაზე. ერთადერთი კონტეინერი, რომლის შენახვასაც შეძლებს, დაახლოებით ექნება მოცულობა:
მონაცემები: O = 16, R = 0,082 ატმოსფერო. ლ / მოლი. კ
ა) 4.50 ლ ბ) 9.00 ლ გ) 18.0 ლ დ) 20.5 ლ ე) 36.0 ლ
T = 277 ºC, რაც 273 შედეგს დაემატა 550 K- ში
მ = 19,2 გ
P = 1.5 ატმოსფერო
R = 0,082 ატმოსფერო. ლ / მოლი. K (რადგან წნევა მიეწოდება ატმოსფეროში)
მოცულობა =?
Შენიშვნა: თავდაპირველად უნდა გამოვთვალოთ ჟანგბადის გაზის მოლური მასა, ატომების რაოდენობა გავამრავლოთ ელემენტის მასაზე და შემდეგ დავამატოთ შედეგები:
M = 2.16
M = 32 გ / მოლ
მოცემულ მონაცემებში შეყვანა კლაპეირონის განტოლება, ჩვენ შეგვიძლია დავადგინოთ საჭირო მოცულობა:
P.V = n. RT
PV = მ .რტ
მ
1.5. V = 19,2.0,082.550
32
1.5. V = 865,92
32
1.5.V.32 = 865,92
48 ვ = 865,92
V = 865,92
48
18.04 ლ (დაახლოებით)
მე -5 მაგალითი: (ერთიანი- RJ) 5 მოლი იდეალური გაზი, 27 ºC ტემპერატურაზე, იკავებს 16,4 ლიტრ მოცულობას. ამ რაოდენობის გაზის ზეწოლა არის:
მოცემულია: R = 0,082 ატმოსფერო. ლ / მოლი. კ
ა) 0.675 ატმოსფერო ბ) 0.75 ატმოსფეროს გ) 6.75 ატმოსფეროს დ) 7.5 ატმოსფეროს ე) 75 ატმოსფეროს
T = 27 ° C, რაც 273 შედეგს დაემატა 300 K
n = 5 მოლი
R = 0,082 ატმოსფერო. ლ / მოლი. კ
მოცულობა = 16,4 ლ
P =?
მოცემულ მონაცემებში შეყვანა კლაპეირონის განტოლება, ჩვენ შეგვიძლია დავადგინოთ საჭირო ზეწოლა:
P.V = n. RT
გვ .16.4 = 5,0,082,300
გვ .16.4 = 123
P = 123
16,4
P = 7,5 ატმოსფერო
მე -6 მაგალითი: (Unirio-RJ) 29.0 გ სუფთა და ორგანული ნივთიერება, აირულ მდგომარეობაში, იკავებს 8.20 ლ მოცულობას, 127 ° C ტემპერატურაზე და 1520 mmHg წნევაზე. სავარაუდო გაზის მოლეკულური ფორმულაა: (R = 0,082. ატ. ლ / მოლი K)
ა) გ2ჰ6 ბ) გ3ჰ8 გ) გ4ჰ10 დ) გ5ჰ12 ე) გ8ჰ14
T = 127 ° C, რაც 273 შედეგს დაემატა 400 K
მ = 29 გ
R = 62,3 მმ.ვწყ.სვ. ლ / მოლი. K (რადგან წნევა არის mmHg)
მოცულობა = 8,2 ლ
P = 1520 mmHg
M =?
ამ სავარჯიშოში მოლეკულური ფორმულის დასადგენად, შეიყვანეთ მოცემული მონაცემები კლაპეირონის განტოლება მოლური მასის დასადგენად:
P.V = n. RT
1520.8,2 = 29 .62,3.400
მ
12464 = 722680
მ
12464M = 722680
M = 722680
12464
M = 57,98 გ / მოლ
შემდეგ უნდა განვსაზღვროთ თითოეული მოცემული ალტერნატივის მოლეკულური მასა (ატომების რაოდენობის გამრავლებით) ელემენტის მასით და შემდეგ შედეგების დამატება) იმის დასადგენად, რომელი ემთხვევა ნაპოვნი მასას ადრე:
ა) M = 2.12 + 6.1
M = 24 + 6
M = 30 გ / მოლ
ბ) M = 3.12 + 8.1
M = 36 + 8
M = 44 გ / მოლ
გ) M = 4,12 + 10
M = 48 + 10
M = 58 გ / მოლ, ანუ ნაერთის მოლეკულური ფორმულაა C4ჰ10.
ჩემ მიერ. დიოგო ლოპეს დიასი