ベンゼン環にすでに置換基がある場合、このラジカルは環上の他のすべてのH置換に影響を与えます。 この置換基は、オルトおよびパラダイレクターまたはメタダイレクターであり得る。 しかし、疑問が生じます。
| ベンゼン環に結合した基が置換反応の方向と反応性に影響を与える原因は何ですか? |
| 特定のグループがアドバイザー(無効化)と他のグループをオルソパラ(アクティブ化)にする理由は何ですか? |
これらの2つの質問は、召しを理解することによって答えられます。 電子効果 これらのグループがリングで運動すること。 この効果は、 電気陰性度の違い 置換基がするように、要素間 芳香核の結合を分極し、いくつかの環炭素に正の特性を交互に誘導し、他の環炭素は負の特性を維持します。
| 性格のある炭素原子に新たな置換が起こります 負. |
元素の電気陰性度の順序を念頭に置いて、これらの電子効果が芳香環でどのように発生するかを見てみましょう:F> O> N> Cl> Br> S> C> I> H。
1番目のケース:ラジカル活性化またはオルソからディレクター:
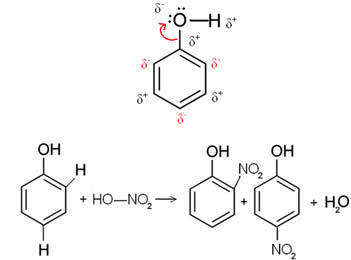
たとえば、ベンゼン(フェノール)分子の下の場合、酸素が最も電気陰性度の高い元素であるため、 それはそれ自体に電子を引き付け、炭素に部分的に正の電荷を持たせ、それが誘導します 交互リング分極. 負の位置は、まさにオルソとパラの位置です。 それが理由です -OH基は活性化ラジカルまたはオルトからダイレクタ. これは、以下のフェノールニトロ化反応で見ることができ、生成物としてo-ニトロフェノールとp-ニトロフェノールを生成します。
今やめないで... 広告の後にもっとあります;)
2番目のケース:ラジカルまたはメタリーダーの非アクティブ化:
ここで、ニトロベンゼンの場合を考えてみましょう。
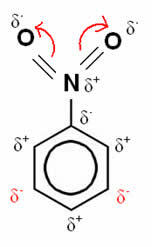
この例では、酸素は依然として最も電気陰性度の高い元素であるため、窒素で作られた結合をそれ自体に引き付けます。 これは部分的に正に帯電しており、それに付着している炭素原子が負に分極するように誘導します。 続けて。 したがって、負になり、置換の影響を最も受けやすい位置は、 ゴール、したがって、 無効にする.
と呼ばれるこの電子効果を今より詳細に見てください 共鳴効果.
| 共鳴効果 これは、ベンゼン環自体と共鳴するときの、二重結合または三重結合のπ(pi)結合への電子の引力または反発です。 |
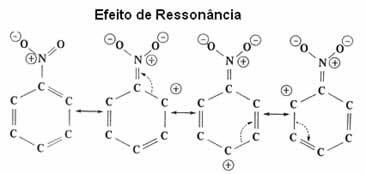
見られるように、NO2基はリングから電子を取り、その電子密度を減少させているため、リングを非アクティブ化しています。 したがって、攻撃して置換を行うグループ(求電子試薬)は正であるため、負の電荷を帯びたメタ位置を優先的に攻撃します。
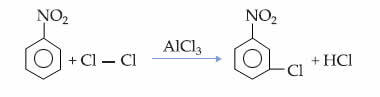
この事実は、ニトロベンゼンのモノクロル化反応で見ることができます。この反応では、置換はメタ位でのみ発生します。
ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "メタおよびオルソからダイレクタへのラジカルの電子効果"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/efeitos-eletronicos-radicais-meta-orto-para-dirigentes.htm. 2021年6月28日にアクセス。