すべてのセルは、電流を生成する自発的な酸化還元反応が発生するデバイスであり、電流は、いくつかの機器を動作させるために使用されます。
これらのデバイスの名前は、最初に作成されたバッテリーがAlessandroによって発明されたために付けられました。 1800年に、それは浸された綿によって分離された亜鉛と銅のディスクによって形成されました 塩水。 このセットは、上下に散らばって配置されました。 山積み ディスクと大きな柱を形成します。 どうでしたか 電池 ディスクの、その名前で呼ばれるようになりました。

バッテリーは常に2つの電極と電解質で構成されています. 正極は 陰極 そしてこれはの反応がどこにあるかです 削減. 負極は アノード そしてこれはの反応がどこにあるかです 酸化. 電解質はまた呼ばれます 塩橋 とはイオン伝導ソリューションです。
これがどのように電流を生成するかを理解するには、最初のバッテリーの1つである ダニエルの山、硫酸銅(CuSO)の溶液が入った容器がありました4(aq))そして、その溶液に浸したのは銅板でした。 別の別の容器に、硫酸亜鉛(ZnSO)の溶液がありました。4(aq))と浸漬亜鉛板。 2つの溶液は、硫酸カリウム溶液(K2のみ4(aq))両端にグラスウールを使用。 最後に、2つのプレートは、ランプを備えた外部回路によって相互接続されました。ランプの照明は、電流の通過を示します。
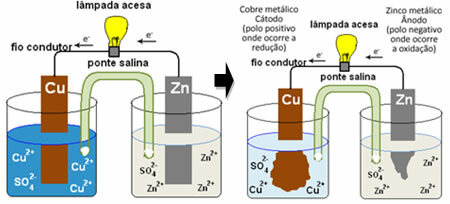
何が起こるかというと、亜鉛は酸化する、つまり電子を失う傾向が強いため、ブレードの金属亜鉛は、酸化が発生する負極、アノードとして機能します。 亜鉛(s) ↔Zn2+(ここに) +2および-. 亜鉛によって失われた電子は、外部回路によって銅に輸送され、ランプをオンにする電流を生成します。 溶液中の銅イオンは電子を受け取り(還元)、金属銅に変化して銅シート上に堆積します。 これは、これが正極、陰極であり、還元が発生することを意味します。 お尻2+(ここに) +2および- ↔お尻(s)。
今日の電池はこれと同じ動作原理を持っており、ある金属が導電性溶液を介して別の金属に電子を供与し、電流が生成されます。 違いは、ダニエルのバッテリーのように電解質として液体溶液を使用しないため、今日使用されているバッテリーは乾燥していることです。
今日、商業的に販売されている非常に多種多様なバッテリーがあります。 それらの中で最も一般的なのは 酸セル(ルクランシェ製) そしてそのアルカリ電池.
どちらも負極として亜鉛を使用しています。 一方、正極としては、二酸化マンガン(MnO)に囲まれた杭の中央にグラファイトバーが設置されています。2)、粉末炭(C)およびウェットペースト。 違いは、アシッドパイルでは、ウェットペーストに塩化アンモニウム(NH)が使用されていることです。4Cl)および塩化亜鉛(ZnCl2)-酸性塩-水に加えて(H2O)。 アルカリ乾電池には、塩基である水酸化カリウム(KOH)を使用しています。

ルクランシェ電池は、リモコン、掛け時計、携帯ラジオ、おもちゃなど、軽くて連続的な放電が必要な機器に最適です。 一方、アルカリ乾電池は、同じサイズの一般的な電池よりも50〜100%エネルギーが高いため、次のような機器に推奨されます。 ラジオ、CD / DVDプレーヤー、ポータブルMP3、懐中電灯、デジタルスチルカメラなどのより高速でより強力なダウンロードが必要です 等

これらのバッテリーや他のタイプのバッテリーにも使用されている電解質と電極の詳細をご覧ください。 最も推奨される機器の種類については、関連記事をもっと読んでください ベローズ。
ジェニファー・フォガサ
化学を卒業

