THE 簡単な蒸留 の方法にすぎません 混合物の分離、特に 均一な混合物 水中の塩化ナトリウム(NaCl)などの液体に溶解した固体によって形成されます。

塩化ナトリウムは簡単な蒸留から得ることができます
それを理解する必要があります 簡単な蒸留、2つの基本的な物理的状態変換が常に発生します。 気化 (液体から気体への通過)および 結露 (蒸気から液体への通過)。
実験室では、 簡単な蒸留、次の機器が必要です。
ブンゼンバーナーまたは加熱プレート(1):混合物を加熱するために使用される機器。
蒸留フラスコ(2): 混合物が加熱を受けるために詰められる容器。
ユニバーサルサポート(3): 爪を取り付けるために使用される機器。
爪(4): 蒸留フラスコを保持するために使用される機器。
体温計(5): 実験中に温度を測定するために使用される機器。
ストッパー(*): 蒸留フラスコの上端を閉じるための木製材料。
コンセント(6): 温水が出る経路。
給水口(7): 冷水が入る経路;
コンデンサー(8): 実験中に結露が発生する機器。
三角フラスコまたはビーカー(9): 蒸留液を採取する容器。
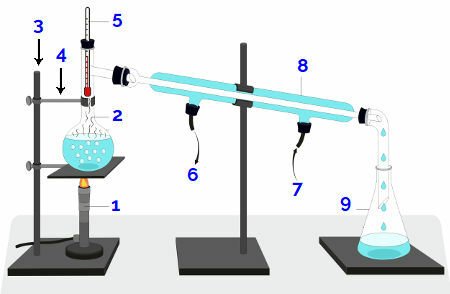
蒸留器の概略図
のパフォーマンス中に 簡単な蒸留、次のイベントがあります。
最初: 蒸留装置が組織されています。
2番目: 混合物(例えば、水と塩化ナトリウム)を蒸留フラスコに加える。
第三: 混合物の加熱は、ブンゼンバーナーまたは加熱プレートを使用して蒸留フラスコで開始されます。
ルーム: 水は蒸留フラスコ内で気化し始めます。
5番目: バルーンの上部が閉じているため、水蒸気は必然的に蒸留器に入り、再び液体に変わります。
6番目: 次に、凝縮した液体をビーカーまたは三角フラスコに集めます。

蒸留液の表現
私によって。DiogoLopesDias
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-destilacao-simples.htm

