で 化学結合 原子間で発生する相互作用で、化合物の分子または基本物質になります。 リンクには次の3つのタイプがあります。 共有結合、金属 そして イオン性。 原子は、化学結合を作ることによって、電子的に自分自身を安定させようとします。 このプロセスはによって説明されます オクテット理論、これは、安定性を達成するために、各原子がその価電子殻に8つの電子を持たなければならないことを指示します。
化学結合とオクテット則
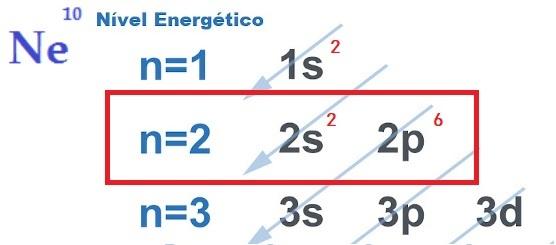
THE 横滑り防止装置を検索し、 これは、原子間の化学結合の実現を正当化するものであり、 オクテット理論. ニュートンルイスによって提案されたこの理論は、各元素が希ガスの安定性を獲得するように原子相互作用が起こると述べています。 の8つの電子 原子価層.
このために、要素 与える、受け取る、または共有する その最外殻からの電子、したがって、イオン性、共有結合性、または金属性の化学結合を形成します。 君は 希ガス それらは、最外殻にすでに8つの電子を持っている唯一の原子であり、それが他の元素とあまり反応しない理由です。
見てまた: 電子配布ルール:それを行う方法は?
化学結合の種類
オクテット則によって予測されるように価電子シェル内の8つの電子を取得するために、原子は互いに結合します。 これは、電子を提供、受信、または共有する必要性と、結合原子の性質によって異なります。
イオン結合
としても知られている エレクトロバレントまたはヘテロポーラ結合、間で発生します 金属 そして非常に電気陰性度の高い元素(金属と水素)。 このタイプの通話では、 金属は電子を失う傾向があります、 陽イオン(陽イオン)に変わる、 非金属と水素は電子を獲得し、 陰イオン(マイナスイオン)になります。
君は イオン性化合物 硬くて脆く、沸点が高く、伝導性が高い 電流 それらが液体状態にあるか、水で希釈されているとき。
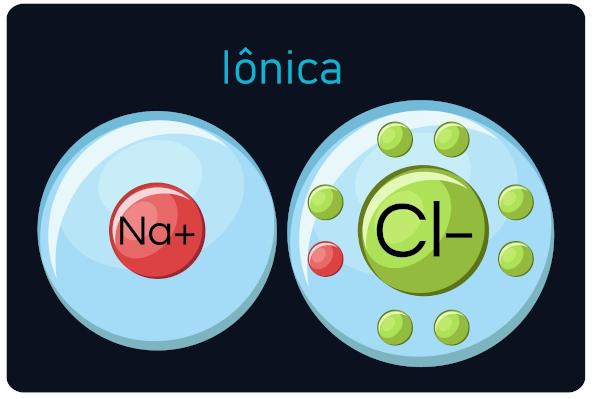
観察: 電子を獲得する原子は負の符号のイオンになり、電子を失う原子は正の符号になることに注意してください。
イオン性物質の例:
- 重炭酸塩(HCO3-);
- アンモニウム(NH4+);
- 硫酸塩(SO4-).
このタイプの化学結合の詳細については、次のテキストをご覧ください。 イオン結合.
共有結合
で 共有結合 によって起こる 電子共有. 結合要素間の電気陰性度の差が小さいため、それらは電子を提供または受信しませんが、 電子ペアを共有する オクテット則に従って安定するようにします。 このタイプの接続は、Clなどの単純な要素で非常に一般的です。2、H2、O2、そしてまた炭素鎖で。 の違い 電気陰性度 リガンド間の結合は、結合が極性であるか非極性であるかを決定します。

あまりにも読んでください:分子の極性:どのように識別するか?
配位結合
とも呼ばれている 配位共有結合、半極性、与格または配位結合、 共有結合と非常によく似ていますが、2つの違いは、配位結合の原子の1つが2つの電子の共有に関与していることです。 このタイプの接続では、 人工的に発生します、分子は、自発的な共有結合から生じる分子と同じ特性を獲得します。
金属リンク
この種の結合は金属間で起こります、1Aファミリー(アルカリ金属)、2A(アルカリ土類金属)、遷移金属(周期表のブロックB-グループ3から12)の元素を含み、私たちが呼ぶものを形成します 金属合金. 他のタイプの接続に関連する差動特性は次のとおりです。 電子の動き、これは、固体状態の金属材料が優れた電気および熱伝導体であるという事実を説明しています。 さらに、金属合金は、高い融点と沸点、延性、展性、および光沢を備えています。 金属合金の例は次のとおりです。
鋼:鉄(Fe)および炭素C;
青銅:銅(Cu)+スズ(Sn);
真ちゅう:銅(Cu)+亜鉛(Zn);
金:金(Au)+銅(Cu)または銀(Ag)。

概要
- 化学結合: 電子的安定性を求める原子間の相互作用。
- 通話の種類: イオン性、共有結合性、金属性。
- オクテット則: 原子が安定するためには、その価電子殻に8つの電子がなければならないことを定義しています。
解決された演習
質問1 -(Mackenzie-SP)硫黄原子とカリウム原子が希ガスと同等の電子配置を取得するには、次のことが必要です。
(データ:原子番号S = 16; K = 19)。
a)硫黄は2つの電子を受け取り、カリウムは7つの電子を受け取ります。
b)硫黄は6個の電子を与え、カリウムは7個の電子を受け取ります。
c)硫黄は2つの電子を生成し、カリウムは1つの電子を生成します。
d)硫黄は6つの電子を受け取り、カリウムは1つの電子を放棄します。
e)硫黄は2つの電子を受け取り、カリウムは1つの電子を放棄します。
解決
代替E。 硫黄は6Aまたは16ファミリーに属し、オクテット則に従うため、価電子シェルに8を含めるには、2つの電子を取得する必要があります。 一方、カリウムは周期表の最初のファミリー(1Aまたは水素ファミリー)に属し、その原子価層に希ガスの構成を持つために、1つの電子を失う必要があります。 2つのカリウム原子と1つの硫黄原子を組み合わせることで、両方の元素が電気的に安定したイオン結合を確立できます。
質問2 -(UFF)母乳は、タンパク質、脂肪、糖などの有機物質とリン酸カルシウムなどのミネラル物質が豊富な食品です。 これらの有機化合物は、分子の形成において共有結合を主な特徴として持っていますが、鉱物はイオン結合も持っています。 それぞれ共有結合とイオン結合の概念を正しく提示する代替案を確認してください。
a)共有結合は有機化合物でのみ発生します。
b)共有結合は電子移動によって行われ、イオン結合は反対のスピンと電子を共有することによって行われます。
c)共有結合は原子間の電荷の引力によって作られ、イオン結合は電荷分離によって作られます。
d)共有結合は分子内の原子を結合することによって作成され、イオン結合は化学複合体内の原子を結合することによって作成されます。
e)共有結合は電子を共有することによって行われ、イオン結合は電子移動によって行われます。
解決
代替E。
他のものを見てみましょう:
- 代替:共有結合はCOなどの無機化合物でも発生するため正しくありません2.
- 代替案b:共有結合は共有によって発生し、イオン結合は電子移動によって発生するため、正しくありません。
- 代替案c:共有結合とイオン結合はどちらも、原子核間の静電引力ではなく、電子を失ったり獲得したりする必要性によって発生します。
- 代替案d:共有結合とイオン結合の両方の結合は、分子内の原子の結合によって発生します。
質問3 -(PUC-MG)周囲条件下でのX、Y、Zの3つの物質の特性を示す表を確認します。
| 物質 | 融解温度(c°) | 電気伝導性 | 水への溶解度 |
| バツ | 146 | 無し |
可溶性 |
| y | 1600 | 高い | 不溶性 |
| z | 800 | 水に溶けたり溶けたりしただけ | 可溶性 |
この情報を考慮すると、物質X、Y、およびZがそれぞれ次のようになっていると述べるのは正しいことです。
a)イオン性、金属性、分子性。
b)分子、イオン、金属。
c)分子、金属、イオン。
d)イオン性、分子性、金属性。
解決
代替C。
物質Xは分子結合であり、共有結合とも呼ばれます。 配位子間の電気陰性度の差がないため、沸点が低い とても背が高い。 一般に、共有結合性化合物には導電性がなく、溶解度は変動します。
金属は融点が高く、導電性に優れ、水に溶けないため、物質Yは金属であると認識できます。
最後に、物質Zはイオン性です。これは、この物質の融点が比較的高いためです。これは、分子の結晶配列の結果です。 イオン性物質が水または液体状態で溶解すると、遊離イオンが存在するため、電子伝導性で水溶性になります。
Laysa BernardesMarques著
化学の先生
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm