で 分子間力、一般的に呼ばれる ファンデルワールス力、 3つあります: 誘導双極子誘導双極子、水素結合、および永久双極子-永久双極子。 このテキストでは、これら3つの力の最後のものだけを検討します。
パワー パーマネントダイポール-パーマネントダイポール、または単に、 ダイポール-ダイポール でのみ発生します 極性分子つまり、表面に沿って均一な荷重分布を持たないものです。 例を挙げると、HCl(塩酸ガス)の分子では、電子雲は水素よりも電気陰性度が高いため、塩素原子に向かって移動します。
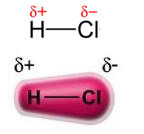
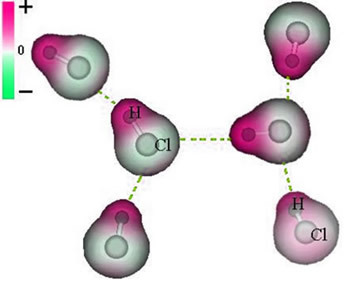
塩素原子の周りに電子の蓄積があり、それが 負極、ギリシャ文字のデルタで象徴されています (-δ). その結果、水素原子の周りの領域では、 正極 (+δ), 電子密度が低いためです。 次に、HCl分子は 電気双極子 したがって、他の隣接するHCl分子と接触すると、以下に示すように、分子の反対の極の間に引力があります。
今やめないで... 広告の後にもっとあります;)
ある分子の双極子の負の端と別の分子の双極子の正の端との間に確立されるこの引力は、双極子-双極子力を構成します。.
そのため、名前が示すように、双極子は永続的であるため、極性化合物でのみ発生します。 また、分子の極性が高いほど、物質内の双極子間相互作用が強くなります。
それが固相にある場合、永久双極子の形成は、空間内の各分子の位置を導き、形成します 双極結晶; 以下に示す臭化水素の場合のように:
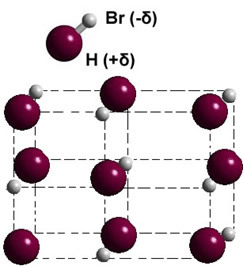
分子間に双極子-双極子強度を持つ極性物質の他の例は次のとおりです。H2S、CO、HCCl3、のみ2.
この分子間力は 中程度の強度、誘導された双極子によって誘導された双極子引力よりも強いが、水素結合よりは弱いため。 これが、それらの融点と沸点が、誘導された双極子強度を持つ物質よりも高い理由です。 永久双極子力が強いので、その分子の相互作用が崩壊するためにより多くのエネルギーを供給する必要があります。
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "双極子-双極子分子間力"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. 2021年6月27日にアクセス。
e)OS2、HBr、HCl、H2O。
c)CHの沸騰温度が3ClとCH3Iはそれぞれ24.0°Cと42.4°Cであり、液相でどの化合物がより強い分子間力を示すかを示しています。