化学を学ぶ人々にとっての大きな課題の1つは、電子配布と呼ばれています。 この文脈で提示しようとしていることは、科学者ライナス・ポーリングによって提案された電子配置に関連するあなたの研究を大いに促進することができます。
各層またはエネルギーレベルに適合する電子の最大数は、次の表に示されています。
エネルギー準位層の最大電子数
1番目のK2
2番目のL8
3番目のM18
4番目のN32
5°O32
6番目のP18
第7四半期8
サブレベルのエネルギーの昇順は、対角線の順序です。 ライナス・ポーリングの図を以下に示します。
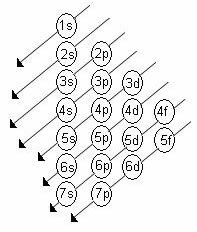
基本的なルール:
1. 中性状態の元素の原子番号(Z)は、分布する電子の数を示します。 この番号は、要素記号の左下部分に表示されます。
2. ポーリング図を使用して、エネルギーの昇順(矢印の方向)を考慮して、電子を上から下に分配し始めます。
3. サブレベルを最大レベルの電子で満たします。 特定のサブレベルが6つの電子しか保持しない場合は、その量を超えないようにしてください。
4. 各サブレベルで電子を合計して、電子の数を確認します。
それを実践しましょう。
鉄原子の電子を分配します(Z = 26)。
原子番号が26の場合、通常の鉄原子には26個の電子があることを意味します。 ポーリング図を適用すると、次のようになります。
今やめないで... 広告の後にもっとあります;)

リリア・アルベス
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "電子配信ルール"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm. 2021年6月27日にアクセス。