アメリカの化学者ギルバートN。 ルイス(1875-1946)は、オクテット則を提案しました。
「さまざまな元素の原子が化学結合を確立し、電子の電子配置を取得するために、電子を提供、受信、または共有します。 希ガス、つまり、最後のシェルに8個の電子があります(または、電子殻が1つしかない原子の場合は、2個の電子があります。 水素)。"
1916年、ルイスは安定を維持し、オクテットまたはデュエットに到達することを提案しました。 分子物質 電子対共有を実行します。 これらの物質は、 水素、非金属および半金属、すべて 電子を受け取る傾向. したがって、それらのいずれかが電子を提供する方法はありません(イオン結合の金属で発生するように)が、 誰もが受け取る必要があるので、共有結合を介して電子を共有します。 分子。
したがって、ギルバート・ルイスは共有結合または分子結合を表す方法を提案しました。 ルイス式. 彼女はまた呼ばれます 電子式 またはまだ、 ルイスの電子式、その主な機能はそれであるため は、各原子の価電子シェル内の電子と電子ペアの形成を示しています。
各電子はドットで表されます。、対応する化学元素の記号を囲みます。 価電子のみが元素の周りにあります。
次の表に示すように、価電子シェル内の電子の量を知るには、周期表ファミリーを知っているだけです。

ルイス式では、 各共有電子対は化学(共有)結合を表します, ここで、電子は、互いに結合されている原子の各ペアに共通するエレクトロスフィアの領域で出会う。 したがって、表現では、それらは並べて配置されます。
たとえば、水素ガスのルイス式が何であるかを調べてみましょう。水素ガスの分子式は次のとおりです。H2.
この元素は周期表のファミリー1に属しているため、各水素原子の価電子は1つだけです。 安定するためには、K電子殻に2つの電子があり、それぞれがもう1つの電子を受け取る必要があります。 したがって、彼らは電子を共有し、両方が2つを取得します。 見てください:
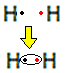
これは水素ガス分子のルイス式です。
酸素の電子殻には6つの電子があるため、安定させるには、それぞれがさらに2つの電子を受け取り、8つの電子を受け取る必要があります。 したがって、酸素ガス分子のルイス式は次のようになります。

2つの共有ペアがあるため、2つのリンクがあることを確認してください。
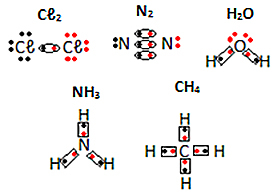
以下の分子物質の電子式の他の例を参照してください。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm
