私たちは 化学反応を伴わない異なる溶質との溶液の混合 共通の同じイオン(同じ陽イオンまたは同じ陰イオンのいずれか)を持つ物質を含む2つ以上の混合物の場合。 以下の例のように:
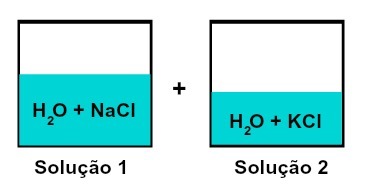
溶質が異なる溶液の混合物
溶液1は水と塩化ナトリウム(NaCl)で、溶液2は水と塩化カリウム(KCl)です。 一緒に混ぜると、 化学反応を伴わない異なる溶質溶液の混合、使用される両方の塩が塩化物アニオン(Cl-).
1-化学反応のない異なる溶質溶液の混合物の特性
化学反応なしで溶質が異なる溶液の混合を行う場合、以下の特性が常にチェックされます。
各溶質の質量は変化しません(たとえば、溶液1に10 gの溶質があり、2、30 gの場合、混合後、各溶質の質量は同じになります)、
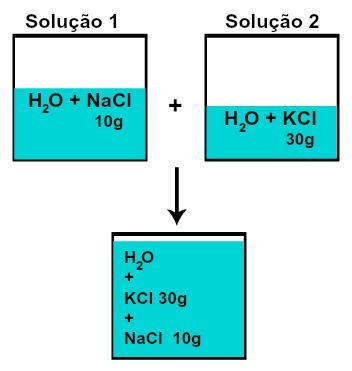
化学反応なしで溶液を混合した後の各溶質の質量
THE 物質量 (n)各溶質は変化しません(たとえば、溶液1に5 molの溶質があり、2、4 molの場合、混合後、それぞれの物質量は同じになります)、
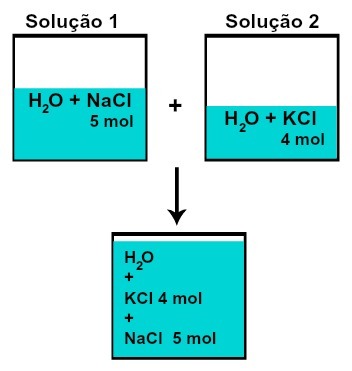
化学反応なしで溶液を混合した後の各溶質のモル数
最終解の体積VFは、混合された各溶液の体積の合計の結果です(たとえば、溶液1に200 mL、溶液2に300 mLの場合、混合後は500 mLの体積になります)、
VF = V1 + V2
2-化学反応なしで異なる溶質の混合溶液の計算に使用される式。
このタイプの混合物のように、それぞれに関連して溶媒の量が増加するだけです。 溶質については、以下を使用して各溶質の最終濃度を計算する必要があります 式:
a)へ 一般的な濃度 (Ç)
溶液1の場合:溶液1の濃度にその体積を掛けると、最終濃度にその体積を掛けたものに等しくなります。
Ç1.V1 = CF.VF
溶液2の場合:溶液2の濃度にその体積を掛けると、最終濃度にその体積を掛けたものに等しくなります。
Ç2.V2 = CF.VF
b)へ 物質量またはモル濃度の濃度 (M)
解決策1の場合:
M1.V1 = MF.VF
解決策2の場合:
M2.V2 = MF.VF
c)溶液中に存在する各イオンの物質量の濃度
最終溶液に存在する1つまたはすべてのイオンの濃度を決定する必要がある場合は、次のことを行う必要があります。
1º: イオン濃度は、それが由来する溶質の濃度(M)に、物質式のインデックスを掛けることによって与えられることを忘れないでください。 したがって、イオンYの場合、物質1、XY3、濃度は次のようになります。
[Y]1 = 3. M
solute2、ZYの場合、Yの濃度は次の式で与えられます。
[Y]2 = 1. M
2º: たとえば、同じイオンを放出する溶質が複数ある場合、XY溶質3 同じイオンYを持つZYは、最終溶液中のこのイオンの濃度は、各溶質の濃度の合計によって与えられます。
[Y]F = [Y]1 + [Y]2
3-化学反応なしで異なる溶質の溶液を混合することを含む計算の例
例1: (PUC SP)ビーカー内で、200 mLの塩化カルシウム(CaCl)水溶液を混合しました。2)濃度0.5mol。 L–1 そして、0.8モルの溶液300ml。 L–1 塩化ナトリウム(NaCl)の。 得られた溶液の塩化物陰イオン濃度はおよそ次のとおりです。
a)0.34モル。 L–1
b)0.65モル。 L–1
c)0.68モル。 L–1
d)0.88モル。 L–1
e)1.3モル。 L–1
演習で提供されたデータは次のとおりです。
解決策1:
ボリューム(V1):200 ml
モル濃度(M1):0.5モル。 L–1
解決策2:
ボリューム(V2):300 ml
モル濃度(M2):0.8モル。 L–1
塩化物陰イオン(Cl-)、次の手順に従う必要があります。
ステップ1: 最終的なソリューションのボリュームを計算します
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
ステップ2: CaCl溶質に対する最終溶液のモル濃度を計算します2、以下の式を使用します。
M1.V1 = MF.VF
0.5,200 = MF.500
100 = MF.500
100 = MF
500
MF = 0.2モル。 L–1
ステップ3: 塩化物のモル濃度を計算する[Cl-]1、最終溶液では、CaCl溶質から2、以下の式を使用します。
注意: 溶質の式CaClでは、Clにインデックス2があるため、式ではモル濃度に2を掛けています。2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0.4モル。 L–1
ステップ4: 以下の式を使用して、NaCl溶質に対する最終溶液のモル濃度を計算します。
M2.V2 = MF.VF
0.8,300 = MF.500
240 = MF.500
240 = MF
500
MF = 0.48mol。 L–1
ステップ5: 塩化物のモル濃度を計算します、[Cl-]2、最終溶液では、NaCl溶質から、次の式を使用します。
注意: 溶質NaClの式では、Clにインデックス1があるため、式ではモル濃度に1を掛けています。
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0.48mol。 L–1
ステップ6: 最終溶液中の塩化物イオンの総量を計算します
これを行うには、ステップ3と5で各溶質の塩化物のモル濃度を追加するだけです。
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0.88mol。 L–1
例2: 500mlの6mol / LKOHの溶液に300mlのK溶液を加えた。2のみ3 3mol / L。 得られた混合物中の各溶質の濃度はどれくらいですか
a)3.75および3.0 mol / L
b)3.75および1.215 mol / L
c)4.5および1.125 mol / L
d)3.75および1.125 mol / L
e)4.5および1.215 mol / L
演習で提供されたデータは次のとおりです。
解決策1:
ボリューム(V1):500 ml
モル濃度(M1):6モル。 L–1
解決策2:
ボリューム(V2):300 ml
モル濃度(M2):3モル。 L–1
塩化物陰イオン(Cl-)、次の手順に従う必要があります。
ステップ1: 最終的なソリューションのボリュームを計算します
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
ステップ2: 次の式を使用して、KOH溶質に対する最終溶液のモル濃度を計算します。
M1.V1 = MF.VF
6,500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3.75モル。 L–1
ステップ3: 溶質Kに関連する最終溶液のモル濃度を計算します2のみ3、以下の式を使用します。
M2.V2 = MF.VF
3,300 = MF.800
900 = MF.800
900 = MF
800
MF = 1.125mol。 L–1
私によって。DiogoLopesDias
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm
