THE ヘモグロビン 脊椎動物の血液、より正確には細胞内に見られるタンパク質です。 血液 赤血球と呼ばれます。 このタンパク質は タンパク質球状 これは、4つのサブユニットによって形成される四次構造を示します。 それはほとんどすべての脊椎動物の呼吸色素であり、 血の典型的な赤い色.
あまりにも読んでください:赤血球
→ ヘモグロビン構造
ヘモグロビンは、4つのサブユニットによって形成される四次構造を持つタンパク質です。 各サブユニットは、 部分タンパク質 (グロビン)と グループ補綴 (ヘム)。 グロビンにはさまざまな種類があり、ヘモグロビンは2つのアルファグロビンと2つの非アルファグロビンによって形成されます。 次に、ヘムグループには鉄原子があり、通常は鉄の形をしています。
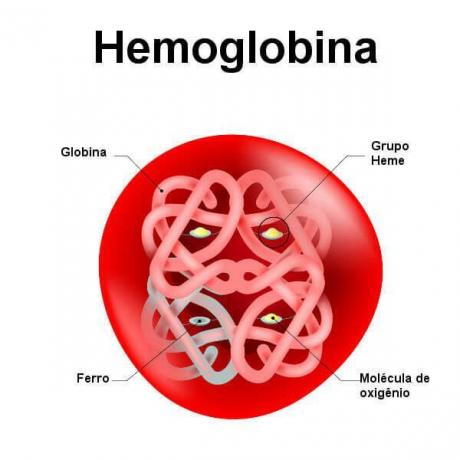
ヘモグロビンの構造を示す概略図を見てください。
→ ヘモグロビンの種類
ポリペプチド鎖の変化により、さまざまな種類のヘモグロビンが観察されます。 ヘモグロビン:A1、A2、Fは正常と見なされます。
ヘモグロビンA1- 正常な成人では、このヘモグロビンは見つかったヘモグロビンの約97%に相当します。
ヘモグロビンA2- このヘモグロビンは、成人に見られるヘモグロビンの2%に相当します。
ヘモグロビンF- このヘモグロビンは胎児に見られ、胎児ヘモグロビンと呼ばれます。 胎児では、出生後に崩壊するこのタイプのヘモグロビンのみが見つかります。 人が8か月に達するまでに、彼または彼女はこのヘモグロビンの1%しか持っていません。
あまりにも読んでください: 献血
→ ヘモグロビン機能
ヘモグロビンは タンパク質 主に関連する 輸送に酸素 私たちの体によって。 ヘモグロビンには4つのサブユニットがあり、それぞれに酸素の結合部位があります。 これらのサイトがより多く満たされると、酸素親和性が増加します。
これは、サブユニットがキャプチャするときに発生します 酸素、 それは他の酸素分子の取り込みに有利なヘモグロビン分子の変化を引き起こします。 したがって、たとえば肺など、ヘモグロビンが豊富な赤血球が高濃度の酸素を含む場所にある場合、ヘモグロビンに対する親和性は高くなります。
組織では、Oの圧力が観察されることは注目に値します2 それは低く、赤血球に存在する酸素が組織に放出されます。 赤血球もCOと結合します2、しかしほとんどのCO2 血漿に溶解して輸送されます。
ヘモグロビンが酸素に結合するとき、それは呼ばれます オキシヘモグロビン. それが酸素にリンクされていないとき、それは呼ばれます デオキシヘモグロビン. それはまだ呼ばれています カルバミノヘモグロビン 二酸化炭素と組み合わせると。
→ 一酸化炭素とヘモグロビン
ヘモグロビンは、体全体に酸素を輸送する主な機能を持っていますが、次のような他の物質と結合することもできます一酸化炭素. この組み合わせが発生すると、ヘモグロビンを カルボキシヘモグロビン。
ヘモグロビンは、酸素よりも一酸化炭素に対して高い親和性を持ち、一酸化炭素に対して推定200倍の親和性があります。 この組み合わせが発生すると、酸素はヘモグロビンによって輸送できなくなり、それによって体の組織の酸素化が不足します。 この問題は深刻であり、原因となる可能性があります 呼吸器の不快感、頭痛、視覚の変化、頻脈、失神、さらには死。
→ 血中ヘモグロビン濃度が低い
血中のヘモグロビンの低濃度は、 貧血。 場合によっては、貧血は少量から発生します 赤血球、 しかし、他の時には、赤血球はほとんどヘモグロビンを持っていません。 この健康問題は、たとえば出血や食事不足が原因で発生する可能性があります。 貧血は、倦怠感、脱力感、蒼白、体力の喪失または喪失など、さまざまな不快な症状を引き起こします。
あまりにも読んでください: 健康的な食事のための推奨事項
→ 鎌状赤血球貧血
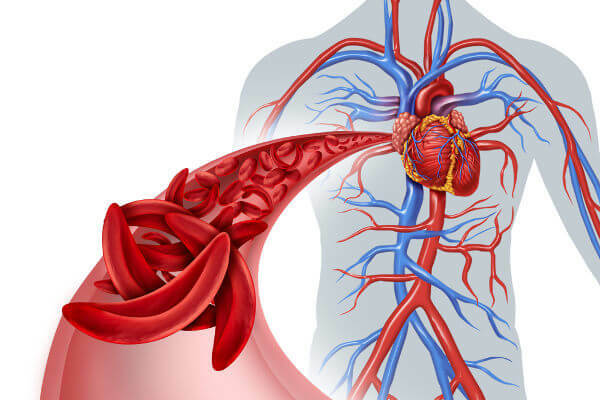
鎌状赤血球貧血では、赤血球は鎌状になります。
THE 鎌状赤血球貧血 それはヘモグロビンの変化によって引き起こされる健康問題です。 これらの場合に観察されるのは、ヘモグロビンのアミノ酸が置き換えられ、異常なヘモグロビン(Hb S)を形成することです。 このヘモグロビンは、 異なる形の赤血球、鎌に似ています。 この赤血球は通常よりも壊れやすく、柔軟性がなく、寿命が短いです。
鎌状赤血球貧血の人は、次のようなさまざまな兆候や症状を経験する可能性があります 倦怠感、蒼白, 痛み、 血管の閉塞、感染症の増加、脚の傷が原因です。 治療はそれぞれの症例に依存し、一部の患者では輸血を伴います。
ヴァネッサ・サルディーニャ・ドス・サントス

