ハイブリダイゼーション。 は、不完全な原子軌道の融合または結合に付けられた名前であり、 共有結合 原子ができること。 軌道は、電子を見つける可能性が高い原子の領域であることを思い出してください。
原子が作る結合の数を知り、の現象を理解する ハイブリダイゼーション、アトムに関するいくつかの基本的なポイントを知る必要があります。
1O ポイント:エネルギーサブレベル
原子が持つことができるエネルギーのサブレベルは、s、p、d、fです。
2O ポイント:サブレベルごとの軌道の数
以下に示すように、各エネルギーサブレベルには異なる量の軌道があります。
サブレベルs:1軌道;
pサブレベル:3軌道;
サブレベルd:5軌道。
これらの軌道の一般的な表現は次のように行われます。
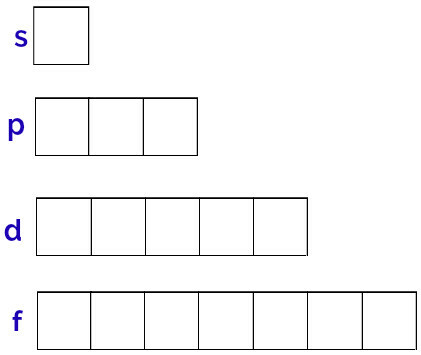
各サブレベルの軌道の表現
パウリによれば、軌道は最大2つの電子を持つことができます。 スピン (回転運動)反対。
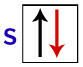
電子によるs軌道の表現
Hundによれば、サブレベルの軌道は、そのサブレベルの他のすべての軌道がすでに最初の電子を受け取っている場合にのみ、その2番目の電子を受け取ります。
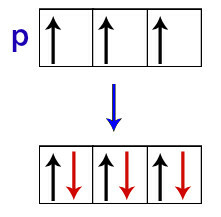
pサブレベル軌道における電子の分布
3O ポイント:電子配信
混成軌道と原子が作る結合の数を理解するには、次のことを実行することが不可欠です。 エレクトロニックディストリビューション ライナス・ポーリングの図。

ライナス・ポーリング図
各サブレベルの電子の最大数は次のとおりです。
s = 2電子;
p = 6電子;
d = 10電子;
f = 14電子。
この簡単なレビューの後、今すぐ定義できます ハイブリダイゼーションとは. このために、化学元素のホウ素を使用します(原子番号 = 5)例として。
ホウ素の電子分配を実行すると、次のようになります。
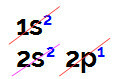
ライナス・ポーリング図における電子ホウ素分布
この分布では、ホウ素のsサブレベルに2つの電子があり、pサブレベルに1つの電子があることがわかります。 原子価層.
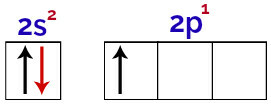
ホウ素原子価層の軌道にある電子
ホウ素には1つの不完全な軌道があるため、結合の数は常に不完全な軌道の数に直接関係しているため、共有結合は1つだけ作成する必要があります。
したがって、ホウ素原子が外部環境からエネルギーを受け取ると、その電子、特に価電子の電子が励起されます。 これにより、s軌道からの電子の1つが離れ、空のp軌道の1つを占有するため、次の画像に示すように、3つの不完全な原子軌道が生成されます。

ホウ素原子の励起状態の表現
最後に、不完全なs軌道と不完全なp軌道の結合があります。 この組合は呼ばれます ハイブリダイゼーション. s軌道と2つのpが融合しているので、 ハイブリダイゼーション sp2.
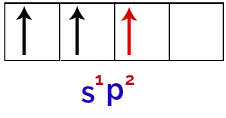
ホウ素原子の混成軌道の表現
ホウ素に加えて、硫黄(S)、キセノン(Xe)、 リン光物質 (P)、 炭素 (Ç)、 ベリリウム (Be)。
私によって。DiogoLopesDias
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm

